이상적인 가스 법률 핵심 개념
이 튜토리얼에서는 이상적인 가스 법률 방정식이 어떻게 도출되었는지와 사용 방법을 알게됩니다. 또한 이상적인 가스를 정의하는 것이 무엇인지, 이상적인 가스 상수, 이상적인 가스 법 단위 및 가스 이상이라고 부르는 가정 - 이상적인 가스 특성.
다른 기사에서 다루는 주제
- 압력이란?
- Dalton의 부분 압력법
- 찰스 법률
- Avogadro의 법칙
- 보일 법
- van der Waal 's Requation
- 운동 가스 이론
- 게이 Lussac의 법칙
- 결합 된 가스 법률
- 헨리의 법칙
소개
이상적인 가스 법칙은 이상적인 가스를 설명하는 상태 방정식입니다. 이 상태 방정식은 가스의 압력, 부피, 온도 및 질량과 관련이 있으며 이상적인 조건에서 가스가 어떻게 작동하는지 설명하는 데 매우 유용합니다. 이것은 가스에 대한 가장 일반적인 상태 방정식입니다.
주목할만한 몇 가지 주목할만한 것은 van der Waal 's와 virial State 방정식이며, 둘 다 nonideal 의 가스 상태를 설명합니다. 주. 이에 대한 자세한 내용은 Van der Waal의 방정식에 관한 기사를 참조하십시오.
이상적인 가스 방정식은 1834 년 Benoît Paul Émile Clapeyron이 Boyle 's Law, Charles's Law, Avogadro 's Law 및 Gay-Lussac의 법의 조합으로 처음 언급했습니다. Clapeyton은 프랑스 엔지니어이자 열역학의 창시자 중 한 명입니다.
이상적인 가스 특성은 무엇입니까?
가스는 무작위로 서로 끊임없이 충돌하는 많은 입자로 구성됩니다. 가스의 거동을 모델링하고 예측하기 위해 이상적인 가스의 개념이 만들어졌습니다. 가스가 이상적이 되려면 몇 가지 가정이 필요합니다. 이것들은 또한 이상적인 가스 특성으로 볼 수 있습니다 .
- 하나의 경우, 우리는 가스 입자의 부피가 무시할 수 있다고 가정합니다. 이것은 용기의 부피가 가스 입자의 부피보다 훨씬 크다는 것을 의미합니다.
- 우리가하는 두 번째 가정은 가스 입자의 크기가 똑같이 크고 다른 가스 입자와 분자간 힘이 없다는 것입니다.
- 셋째, 우리는 뉴턴의 운동 법칙에 따라 가스 입자가 무작위로 움직이는 것으로 가정합니다.
- 마지막으로, 우리는 모든 충돌이 완벽하게 탄력적이며 에너지 손실이 없다고 가정합니다. 이것은 가스 입자와 벽 사이의 충돌이 에너지를 잃지 않고 일정한 압력을 가하는 것을 의미합니다.
가스는 완벽하게 이상적이지 않지만 대부분의 가스는 실온에서 충분히 가깝고 거의 이상적입니다.
가스 법을 이상적인 가스 법률 방정식에 결합
세 가지 기본 가스 법률 인 Charles '법, Avogadro의 법칙 및 Boyle의 법칙을 고려하면 가스의 압력, 부피, 온도 및 두더지의 양 사이에 관계를 맺을 수 있습니다. 각 방정식을 취하고 결합하여 이상적인 가스 법률 방정식을 도출 할 수 있습니다.
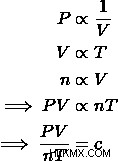
이 비례는 가스 상태의 모든 변화를 고려하기 때문에 이상적인 가스의 경우 일정합니다. 이 상수는 이상적인 가스 상수 로 알려져 있습니다 보편적 가스 상수 및 값이 있습니다. 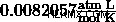 . 우리는이 상수를 연결할 수 있습니다
. 우리는이 상수를 연결할 수 있습니다  , 이상적인 가스 법칙을 도출하기위한 방정식으로,
, 이상적인 가스 법칙을 도출하기위한 방정식으로,  .
.
이상적인 가스 법 단위
다음 단위는 SI 단위 (국제 단위)가 사용될 때 이상적인 가스 법 방정식에 사용됩니다.
- p는 PASCALS, PA. 에서 측정 된 압력입니다
- v는 입방 미터, m 로 측정 된 부피입니다
- n은 두더지의 수입니다.
- r =8.3145는 j/(k · 에서 측정 된 범용 가스 상수입니다. mol) 또는 대안 적으로 m · pa / (k · mol)
- t는 켈빈에서 측정 된 온도입니다.
파스칼과 입방 미터 대신 리터와 압력 대기를 사용하는 경우 다음과 같은 것이 있습니다.
- p는 대기에서 측정 된 압력입니다
- v는 리터로 측정 된 부피입니다
- n은 두더지의 수입니다.
- r =0.08206은 l · atm /(k · 에서 측정 된 범용 가스 상수입니다. mol)
- t는 켈빈에서 측정 된 온도입니다.
이상적인 가스 법칙 예제 문제
- 에탄올과 메탄올의 혼합물을 산소로 연소시켜 35cm의 Co 2 를 생성합니다. 및 55cm의 h 2 O. 완전한 연소가 발생하고 두 제품의 부피는 101kPa 및 120도에서 측정됩니다. 혼합물에서 몰비, 에탄올 대 메탄올은 무엇입니까?

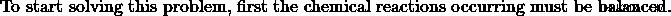
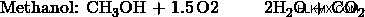
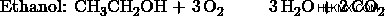
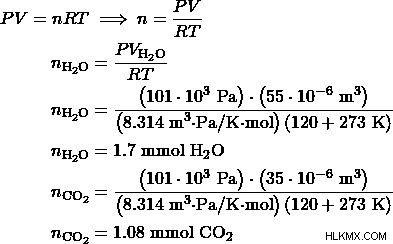
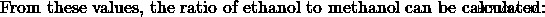
a) 에탄올 :메탄올의 비율을 1 :3로 둡니다. 그런 다음, 메탄올 반응은 에탄올 반응보다 3 배나 발생합니다. 따라서, 메탄올 생성물은 에탄올 생성물보다 3 배가 될 것이다.
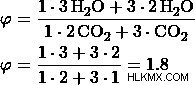
b) 비율을 2 :3로 둡니다.
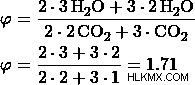
c) 비율을 3 :2로 둡니다.
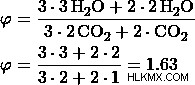
d) 비율을 3 :1로 둡니다
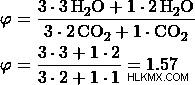
이 값에서 옵션 (d)이 이전에 계산 한 것과 동일한 어금니 비율을 가지고 있으므로 옵션 (d)는 정답입니다.
.