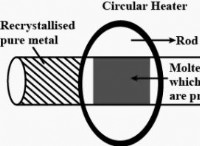
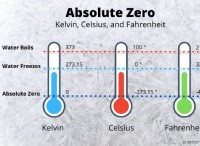
이산화황 (SO2)은 극성입니다 :
* 구부러진 분자 형상 : SO2는 황 원자에 2 개의 고독한 쌍이 존재하기 때문에 구부러진 또는 V 자형 분자 형상을 갖는다. 이 배열은 쌍극자 모멘트를 생성하는데, 이는 분자 내에서 전하가 분리되어 있음을 의미합니다.
* 전기 음성 차이 : 산소는 황보다 더 전기 음성이므로 전자를 더 강력하게 끌어들입니다. 이것은 산소 원자에 부분 음전하를 생성하고 황 원자에 부분 양전하를 생성합니다.
탄소 (C)는 비극성 :입니다
* 대칭 구조 : 탄소 원자는 전형적으로 다른 원자와 4 개의 공유 결합을 형성한다. 메탄 (CH4) 또는 이산화탄소 (CO2)와 같은 분자에서, 이들 결합은 대칭 적으로 배열된다. 이 대칭은 잠재적 인 쌍극자 순간을 취소합니다.
* 유사한 전기 음성 : 탄소는 수소와 같이 결합하는 많은 원소와 비교적 유사한 전기성을 갖는다. 전기 음성의 작은 차이는 전하 분리가 거의 없어서 본드가 본질적으로 비극성을 만듭니다.
키 테이크 아웃 :
SO2와 탄소 모두 공유 결합이 있지만, 분자 기하학 및 전기 음성 차이 원자 사이에서는 그들의 극성을 결정합니다.
* 비대칭 비대칭 분자 기하학 및 상당한 전기 음성 성 차이 원자 사이는 극성으로 이어진다 .
* A 대칭 분자 기하학 및 유사한 전기성 비극성 를 초래합니다 분자.