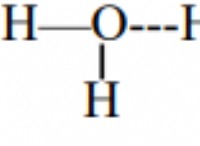분자 화합물 이해
* 정의 : 분자 화합물은 둘 이상의 비금속이 공유 결합을 통해 전자를 공유 할 때 형성된다.
* 특성 :
* 일반적으로 이온 성 화합물에 비해 용융점 및 끓는점이 낮습니다.
* 종종 실온에서 가스, 액체 또는 부드러운 고체입니다.
* 고체 및 액체 상태에서 전기 도체가 열악한 경향이 있습니다.
분자 화합물 식별
1. 요소를 조사하십시오 : 화합물이 주로 비금속으로 구성된 경우 (화합물에 따라 금속 또는 비금속 역할을 할 수있는 수소 제외) 분자 일 가능성이 높습니다.
2. 이름으로 접두사를 찾으십시오. 분자 화합물은 접두사 (mono-, di-, tri- 등)를 사용하여 분자 내 각각의 원소의 원자 수를 나타냅니다. 예를 들어, 이산화탄소 (CO₂)는 2 개의 산소 원자를 나타내는 접두사 "di"를 가지고 있습니다.
3. 채권의 유형을 고려하십시오 : 원자 사이의 결합이 주로 공유 (공유 전자) 인 경우 분자 화합물입니다.
예 :
* 물 (h>o) : 수소와 산소는 모두 비금속이고 결합은 공유입니다.
* 이산화탄소 (Co₂) : 탄소와 산소는 비금속이며 이름은 접두사를 사용합니다.
* 메탄 (ch₄) : 탄소와 수소는 비금속이고 결합은 공유입니다.
예외 :
* 금속을 함유하는 일부 화합물도 분자 일 수 있지만 이것은 덜 일반적입니다. 예를 들어, 수은 (II) 클로라이드 (HGCL)는 금속 수은을 함유 함에도 불구하고 분자이다.
키 포인트 :
* 이러한 방법은 일반적으로 신뢰할 수 있지만 특정 화합물에 대한 교과서 나 평판이 좋은 웹 사이트와 같은 신뢰할 수있는 소스를 참조하는 것이 가장 좋습니다.
* 확실하지 않은 경우 화합물의 특성 (용융점, 전도도)을 고려하여 분류하는 데 도움이됩니다.