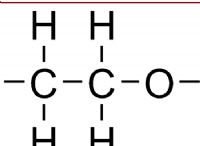
해리 이해
* k₂cro₄ (칼륨 크로메이트) 강한 전해질은 물에 용해 될 때 이온으로 완전히 분리됩니다.
* 해리 반응은 다음과 같습니다.
k₂cro a (aq) → 2k⁺ (aq) + cro₄²⁻ (aq)
키 포인트
* k₂cro₄의 하나의 공식 단위는 3 개의 이온을 생성합니다 : 2 칼륨 이온 (k⁺) 및 1 크로 메이트 이온 (크로 메이트 이온).
따라서, 완전히 용해 될 때 1 mg의 k₂cro₄는 원래 수식 단위에 비해 이온 수의 3 배를 가질 것이다. .
예 :
1mg의 k₂cro₄에는 100 개의 공식 장치가 포함되어 있다고 가정 해 봅시다. 용해 후 :
* 100 x 2 =200 칼륨 이온 (k⁺)이 있습니다.
* 100 x 1 =100 크로 네이트 이온 (cro₄²⁻)이 있습니다.
* 총 이온 :200 + 100 =300 이온
* 이온 수 (300)는 공식 장치 수 (100)의 3 배입니다.
중요한 참고 : 이 설명은 물의 완전한 이온화를 가정합니다. 실제로 이온 페어링과 같은 요인으로 인해 약간의 편차가 발생할 수 있습니다. 그러나, 1 :3 이온 대식 단위 비율의 원리는 칼륨 크로메이트와 같은 강한 전해질에 대해 적용된다.