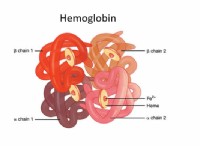
가열 :
* 증가 된 반응 속도 : 시스템을 가열하면 일반적으로 는 반응 속도를 증가시킵니다 . 이것은 다음과 같습니다.
* 운동 에너지 증가 : 열은 분자에 더 많은 운동 에너지를 제공하여 더 빨리 움직이고 더 자주 충돌하게 만듭니다.
* 충돌 에너지 증가 : 운동 에너지가 높을수록 충돌이 더 활력이 넘치는 것을 의미합니다. 충돌이 반응이 발생하기위한 활성화 에너지 장벽을 극복 할 가능성이 높아집니다.
* 충분한 에너지를 가진 더 많은 분자 : 온도가 상승함에 따라, 더 많은 분자는 활성화 에너지를 극복하기에 충분한 에너지를 가질 것이며, 이는 더 빠른 반응 속도를 초래한다.
냉각 :
* 반응 속도 감소 : 시스템을 냉각시키는 것은 일반적으로 는 반응 속도를 감소시킨다 . 이것은 다음과 같습니다.
* 운동 에너지 감소 : 냉각은 분자의 운동 에너지를 줄여서 느리게 움직이고 덜 자주 충돌하게 만듭니다.
* 충돌 에너지 감소 : 운동 에너지가 낮다는 것은 충돌이 활력이 적 으면 충돌이 활성화 에너지 장벽을 극복 할 가능성이 적습니다.
* 충분한 에너지를 가진 분자가 적습니다 : 온도가 떨어짐에 따라, 더 적은 비율의 분자는 활성화 에너지를 극복하기에 충분한 에너지를 가지므로 반응 속도가 느려집니다.
중요한 고려 사항 :
* 평형 : 가열은 전방 반응과 역 반응 속도를 높이지만, 반응이 발열 성인지 흡열인지 여부에 따라 가역적 반응의 평형 점을 이동할 수있다.
* 활성화 에너지 : 반응의 활성화 에너지는 온도 변화에 얼마나 민감한지를 결정하는 기본 특성입니다. 높은 활성화 에너지와의 반응은 온도 변화에 더 취약합니다.
* 반응 순서 : 반응 순서는 또한 온도가 속도에 미치는 영향에도 영향을 미칩니다.
예 :
과산화수소 (HATER)의 물 (HATER) 및 산소 (O₂)로의 분해를 고려하십시오.
2 h 2o→ → 2 h₂o + o₂
이 반응은 발열이므로 열이 방출됩니다. 시스템 가열하면 처음에는 분해 속도가 증가합니다. 그러나 반응이 진행됨에 따라 방출 된 열은 시스템의 온도를 높여 분해 속도가 빠르게 증가하여 더 많은 열이 발생합니다. 이것은 반응을 크게 가속화 할 수있는 긍정적 인 피드백 루프를 만듭니다.
요약 : 시스템을 가열하면 일반적으로 반응 속도가 증가하지만 냉각은 감소합니다. 이는 분자의 운동 에너지에 대한 온도의 영향과 활성화 에너지 장벽을 극복하기에 충분한 에너지를 갖는 분자의 수 때문이다.