산 수소 이온 (H+)을 용액에 기증하는 물질입니다. 산이 물에 용해되면 H+ 이온을 방출하여 용액에서 H+의 농도를 증가시킵니다. 이것은 용액을 더 산성으로 만듭니다 .
베이스 용액에서 수소 이온 (H+)을 수용하는 물질입니다. 염기가 물에 용해되면 용액에서 H+ 이온을 제거하여 용액에서 H+의 농도를 감소시킵니다. 이것은 산성 (더 기본 또는 알칼리성) 를 덜 만듭니다. .
몇 가지 예는 다음과 같습니다.
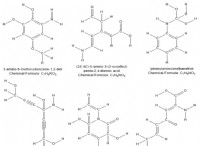
* 산 : 염산 (HCL), 황산 (H2SO4), 아세트산 (CH3COOH)
* 베이스 : 수산화 나트륨 (NAOH), 수산화 칼륨 (KOH), 암모니아 (NH3)
pH 스케일 용액의 산도 또는 알칼리도를 측정하는 데 사용됩니다. 7의 pH는 중성이고, 7 미만은 산성이고, 7 이상은 기본입니다 (알칼리).
수소 이온을 기증하거나 수용하는 산 및 염기의 능력은 다음을 포함한 많은 화학 반응 및 공정의 기초입니다.
* 중화 반응 : 산과 염기가 반응하면 서로를 중화하여 물 (H2O)과 소금을 형성합니다.
* 버퍼 시스템 : 생물학적 시스템은 완충제를 사용하여 안정적인 pH를 유지합니다. 버퍼는 소량의 산 또는 염기가 첨가 될 때 pH의 변화에 저항하는 솔루션이다.
* 산-염기 적정 : 알려지지 않은 산 또는 염기의 농도를 결정하는 데 사용되는 방법.
요약하면, 산과 염기 용액에서 수소 이온의 농도를 변화시킬 수있는 물질이며, 더 산성이거나 염기성이 있습니다. PH의 이러한 변화는 다양한 화학 반응 및 생물학적 과정에서 유의 한 영향을 미칩니다.