* CO2 흡수 : 빗물이 토양과 암석을 통해 여과함에 따라 대기 CO2를 용해시켜 공기의 자연적인 구성 요소입니다.
* 탄산 산 형성 : 용해 된 CO2는 물과 반응하여 탄산산 (H2CO3)을 형성합니다.
CO2 + H2O h H2CO3
* 약산 : 탄산산은 약산으로, 물에서 부분적으로 이온화되어 수소 이온 (H+) 및 중탄산 이온 (HCO3-)을 방출한다는 것을 의미한다.
H2CO3 ⇌ H + + HCO3-
* pH 수준 : 이들 수소 이온의 존재는 지하수를 약간 산성으로 만듭니다. 일반적으로 pH 범위는 6.5 ~ 7.5입니다.
산도에 영향을 미치는 요인 :
* CO2 레벨 : 물에 용해 된 CO2의 양은 대기에서 CO2의 부분 압력과 물과 공기 사이의 접촉량에 따라 다릅니다.
* 락 타입 : 지하 바위와 미네랄의 유형은 물의 산도에 영향을 줄 수 있습니다. 석회암과 같은 일부 암석은 탄산과 반응하여 산도를 완충시킬 수 있습니다.
* 온도 : 더 높은 온도는 일반적으로 CO2 용해도를 낮추어 산도를 감소시킬 수 있습니다.
pH의 중요성 :
지하수의 pH는 다음과 같은 영향을 미치기 때문에 중요합니다.
* 미네랄 용해 : 산성 물은 주변 암석에 미네랄을 녹일 수있어 물의 화학적 조성에 영향을 줄 수 있습니다.
* 생물학적 과정 : pH는 물에 사는 유기체의 생존 및 활동에 영향을 미칩니다.
* 부식 : 산성 물은 파이프 및 기타 인프라를 부식시킬 수 있습니다.
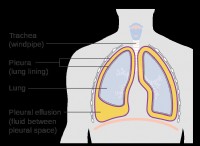
요약 : 항상 강한 산성은 아니지만, 지하수는 탄산을 형성하는 이산화탄소의 용존 이산화탄소의 존재로 인해 종종 약간 산성입니다. 산도 수준은 다양한 요인에 따라 달라질 수 있습니다.