분자 궤도는 궤도가 전체 분자를 동기 사이에 위치시키기보다는 전체 분자를 포함하는 결합을 생성하는 방법입니다. 그것들은 원자 궤도의 조합의 결과입니다. 궤도는 파도 기능이기 때문에, 건설적으로 결합하여 결합 분자 궤도 또는 분열을 형성하여 항비 분자 궤도를 형성 할 수있다.
분자 궤도가 유사한 에너지를 가진 원자의 궤도가 겹칠 때 형성됩니다. 다른 에너지 또는 잘못된 공간 방향 (직교)의 원자 궤도 (직교)는 결합되지 않으며 본드리스 궤도라고합니다.
궤도
궤도는 임의의 위치에서 전자를 찾을 확률을 나타냅니다. 이 궤도는 다른 에너지에 해당합니다. 궤도의 전자에는 일정량의 에너지가 있습니다.
여기에 양자 역학이 궤도를 가장 잘 설명하는 방법
분자 궤도는 한 쌍의 전자 쌍에 의해 점령 된 두 개의 원자 궤도의 겹치기 때문에 형성됩니다.
.
원자 궤도는 전자를 찾을 확률이 가장 큰 원자의 핵 외부의 영역을 나타냅니다 (95 %).
분자 결합 형성
분자 궤도에서 Atomic Orbitals 간의 가능성이 제한되어 있습니다. (그룹 이론에 의해 결정된대로)는 서로 우호적입니다.
분자 결합 유형
상호의 상호 작용할 때, 3 개의 유형의 분자, 그리고 3 개의 타입 및 3 개의 타입이 될 수 있습니다. 비전도.
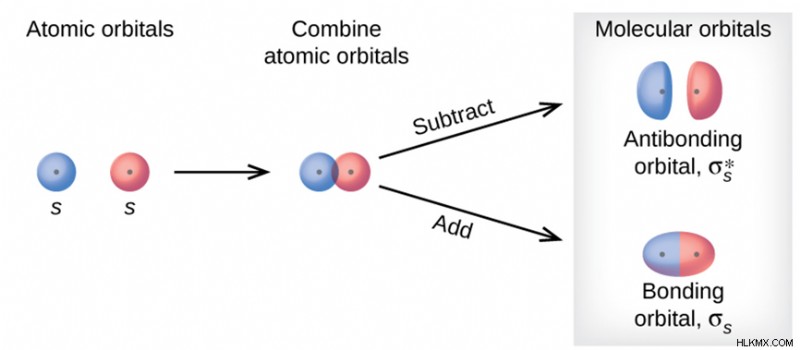
결합 분자 궤도
채권 오브 윤기는 일반적으로 분자 궤도 이론에서 일반적으로 사용됩니다. 분자에서.
결합 분자 궤도의 에너지는 그들이 결합 된 대기의 에너지보다 낮습니다.
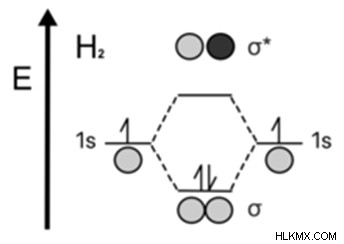
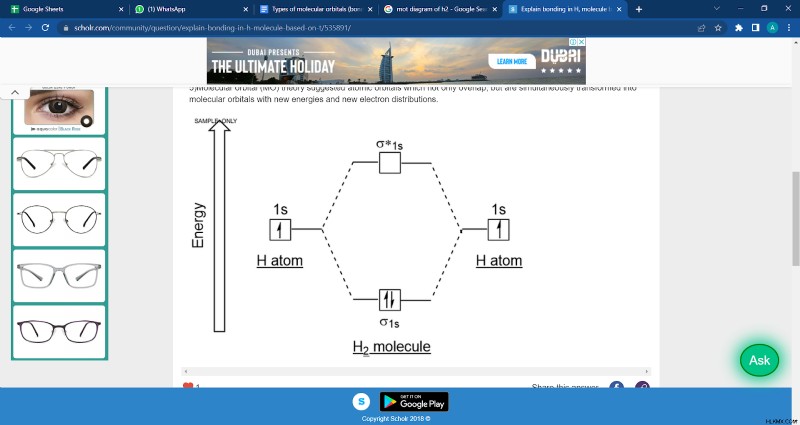
dihydrogen의 모그램
안티 본딩 분자 궤도
화학적 결합 이론에서 6pt 0pt 0pt 0pt ", 항체 궤도 사이의 화학적 유적물의 유성은 화학적 유형의 도움이됩니다. 단일 원자에 대한 분자의 에너지
원자의 궤도 사이의 안티 닝 컨트로 션은 파괴적 (외부-종족)의 웨이브 계획이 적합합니다. 상호 작용하는 입자는 0
입니다안티 딩딩 분자 궤도보다 높은 에너지를 가지고 있습니다.
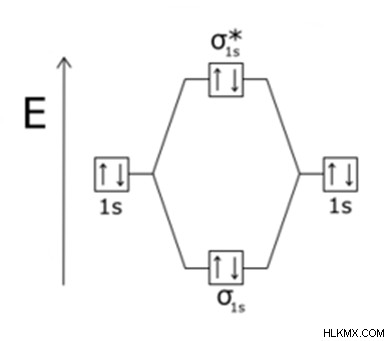
비 결합 분자 궤도
비 결합 분자 궤도로도 알려진 비 결합 궤도는 전자 직업이 관련된 분자 궤도입니다. 따라서 수소 원자에서 S 형 원자가 궤도와 겹치거나 상호 작용할 수 없습니다.
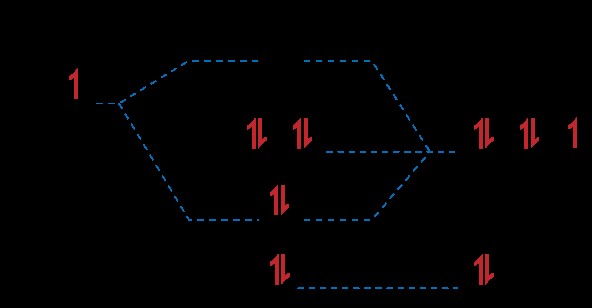
분자 orbital diagrams
분자 궤도 다이어그램은 분자 orbital 이론의 화학적 결합을 설명하는 질적 설명 도구입니다.
분자 궤도 다이어그램은 분자 궤도 에너지 수준의 다이어그램입니다. 맨 위에. 일반적으로 점선, 대각선 선, 분자 궤도 레벨을 구성된 원자 궤도 수준에 연결합니다.
퇴화 에너지 레벨은 일반적으로 나란히 표시됩니다. Pauli 배제 원리에 따르면, 올바른 원자 궤도 및 분자 궤도 에너지 레벨은 전자의 스핀을 나타내는 작은 수직 화살표로 표시되는 전자로 채워져 있습니다.
Aufbau의 원리에 따르면, 우리는이 분자 궤도에서 전자의 분포를 아토미믹 옆에 동일한 방식으로 채우면서 이들 분자 궤도의 전자 분포를 예측합니다.
.
분자 궤도 이론
단순성을 위해, 우리는 밸런스 전자를 포함하는 궤도의 상호 작용을 분자 궤도에 고려할 것입니다. '수소 원자 A'와 '수소 원자 B'의 파도 기능은 건설적으로 또는 파괴적으로 상호 작용할 수 있습니다. 분자 궤도 이론의 목표는 원자, 즉 궤도, 궤도 다이어그램 및 전자 구성 측면에서 우리가 원자를 설명하는 방법과 유사하게 분자를 설명하는 것입니다.
분자 궤도 이론은 화학적 유대를 설명합니다. 이것은 또한 Lewis 구조로 설명하기 어려운 더 복잡한 바인딩 (이 논문의 범위를 넘어서)을 가진 많은 다른 분자와 같은 많은 다른 분자에서의 결합을 설명합니다. 또한 분자에서 전자의 에너지와 전자의 가능한 위치를 설명하는 모델을 제공합니다.
안티 딩 vs 본딩 궤도
대부분의 시간 사이의 전자는 대부분의 경우, 대부분의 경우, 대부분의 경우 전자 핵이 있습니다. 안티 본딩 궤도에 넣었다. 결합 궤도에서의 핵 사이의 전자 밀도는 증가하는 반면, 안티 본딩 궤도의 전자 밀도는 감소한다. 분자가 두 핵 사이에있을 때, 결합 궤도에 전자를 배치하면 분자를 안정화시킨다. 반대로, 전자를 항비 궤도에 배치하면 분자의 안정성을 감소시킨다. 궤도의 에너지 수준에 따라 전자가 채워집니다. 그들은 먼저 낮은 에너지 궤도를 채울 것입니다. 그러면 그들은 더 높은 에너지 궤도를 채울 것입니다. 획득 된 결합 순서가 0이면 분자가 너무 불안정하므로 존재하지 않을 것임을 의미합니다.
결론
합병은 결합 된 아톰의 원자 궤도의 분자 궤도를 만듭니다. 따라서, 전자 배열은 다른 원자 궤도에서 발견되며, 일반적으로 다른 원자 핵과 관련이있다. 분자 궤도 이론은 원자파 기능의 조합 측면에서 분자에서 전자의 거동을 설명합니다. 생성 된 분자 궤도는 분자의 모든 원자에 걸쳐있을 수있다.
분자 궤도 이론은 원자형 궤도가 분자 궤도를 만드는 데 참여한다는 생각에 기능합니다. 각 원자의 전자 밀도는 분자 전체에 분포되기 때문에 전자의 에너지가 감소된다. 겹치는 원자 궤도는 안정적인 분자 궤도를 효과적으로 생성합니다.