이유는 다음과 같습니다.
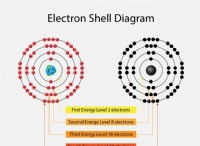
* 전자 구성 : 산소는 전자 구성 1S²2S²2P⁴을 가지며, 크세논은 구성을 가지고 있습니다 [KR] 4D¹⁰5S²5P⁶. 이것은 산소의 가장 바깥 쪽 전자가 2P 서브 쉘에 있고, 크세논의 가장 바깥 전자는 5p 서브 쉘에 있음을 의미합니다.
* 차폐 효과 : 크세논의 5p 전자는 산소의 2p 전자보다 핵에서 훨씬 더 멀다. 그들은 내부 전자에서 더 큰 차폐 효과를 경험하여 핵과 가장 바깥 전자 사이의 인력을 줄입니다.
* 핵 전하 : 크세논은 양성자의 수가 많기 때문에 산소보다 훨씬 큰 핵 전하를 갖는다. 이것은 핵과 전자 사이의 매력을 증가시킵니다.
그러나 크세논의 핵 전하가 더 큰 것은 차폐 효과와 5p 전자의 더 먼 거리를 극복하기에 충분하지 않습니다. 이것은 산소에 비해 크세논에 대한 이온화 에너지가 상당히 낮아진다. .
요약 :
* 산소는 크세논보다 이온화 에너지가 더 높다.
*이 차이는 차폐 효과, 핵으로부터의 거리 및 핵 전하의 조합 때문입니다.