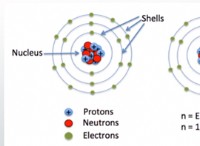
1. 원자 수와 양성자 수 :
* 나트륨 (NA) : 원자 번호 =11은 핵에 11 개의 양성자가 있음을 의미합니다.
* 산소 (O) : 원자 번호 =8은 핵에 8 개의 양성자가 있음을 의미합니다.
2. 전자 수 :
* 나트륨 (NA) : 중립 상태에는 11 개의 전자가 있습니다.
* 산소 (O) : 중립 상태에는 8 개의 전자가 있습니다.
3. 전자 구성 :
* 나트륨 (NA) : 2, 8, 1 (하나의 원자가 전자)
* 산소 (O) : 2, 6 (6 개의 원자가 전자)
4. 화학적 특성 :
* 나트륨 (NA) : 고도로 반응성 금속, +1 양이온 (Na +)을 형성하기 위해 하나의 원자가 전자를 쉽게 잃게됩니다. 강력한 환원제입니다.
* 산소 (O) : 고도로 반응성 비금속은 -2 음이온 (O2-)을 형성하기 위해 2 개의 전자를 얻는 경향이있다. 강력한 산화제입니다.
5. 반응성 :
* 나트륨 (NA) : 매우 반응, 특히 물에있어서 수소 가스와 열을 생성합니다.
* 산소 (O) : 또한 매우 반응성은 금속 (산화물) 및 비금속 (물, H2O)을 포함하여 많은 원소를 갖는 화합물을 쉽게 형성합니다.
6. 물리적 특성 :
* 나트륨 (NA) : 실온에서 은빛 흰색의 부드러운 금속.
* 산소 (O) : 실온에서 무색의 무취 가스.
7. 발생 :
* 나트륨 (NA) : Halite (NaCl, Rob Salt)와 같은 다양한 미네랄에서 발견되며 생명에 필수적입니다.
* 산소 (O) : 지각과 분위기에서 가장 풍부한 요소. 호흡과 연소에 필수적입니다.
요약 :
나트륨과 산소는 크게 다른 원소입니다. 금속 인 나트륨은 전자를 쉽게 잃는 반면, 비금속 인 산소는 2 개의 전자를 쉽게 얻습니다. 전자 구성의 이러한 차이는 크게 다른 화학적 특성과 반응성으로 이어져 우리 주변의 세계에서 뚜렷한 역할을합니다.