핵심 개념
이 튜토리얼에서는 전자 껍질, 다른 서브 쉘 및 전자를 찾을 수있는 궤도에 대해 배우게됩니다.
다른 기사에서 다루는 주제
- 전자 구성을 작성하는 방법
- 전자 궤도 및 궤도 형태
- 시그마와 PI 본드
- 원자가 본드 이론
- 원자의 Bohr 모델
BOHR 모델
Niels Bohr는 1913 년에 원자의 초기 모델을 개발했습니다. Bohr 모델 전자에 따르면 원자의 핵 주위에 고정 된 원형 궤도를 차지합니다. 모든 전자 쉘마다 에너지 수준이 다릅니다. 핵에 가장 가까운 껍질은 에너지가 가장 낮으며 껍질은 더 멀리 떨어진 에너지가 더 높습니다. 각 껍질과 핵 사이의 거리는 그 수를 결정합니다. 각 양자 수는 에너지 수준 후 문자 N이 제공됩니다. 양자 수는 1에서 시작하여 각 에너지 수준에 대해 1 씩 증가합니다. 예를 들어, 핵에 가장 가까운 에너지 수준은 1n입니다.
BOHR 모델은 전자가 특정 순간에있는 위치를 정확하게 표현하지 않습니다. 이 접근법은 단순성으로 인해 여전히 배웁니다.
*원자의 핵 또는 중심에 주목하고 양성자와 중성자가 포함되어 있습니다.
전자 쉘
매우 간단한 용어로 전자 쉘은 원자 핵을 둘러싼 원자의 외부 부분입니다. 껍질은 핵 주위의 전자가 뒤 따르는 궤도 경로입니다. 화학의 모든 것과 마찬가지로 전자는 저항이 가장 적은 경로를 따르기를 좋아합니다. 이것은 전자가 일반적으로 내부에서 원자의 껍질을 채울 것임을 의미합니다. 가장 낮은 에너지 수준에서 시작하여 외출. 각 쉘에는 최대 양의 전자가 있습니다. 예를 들어, 쉘 1n은 2 개의 전자를 고정 할 수 있고, 쉘 2n은 8 개의 전자를 보유 할 수 있으며, 쉘 3N은 18 개의 전자를 담을 수 있습니다. 각 쉘이 담을 수있는 전자 수를 계산하는 규칙은 2n입니다. 예를 들어 첫 번째 껍질은 2 (1)로 2 개의 전자를 제공합니다.
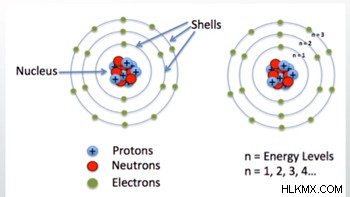
위의 다이어그램에서 에너지 레벨은 원자의 핵 주위의 고리로 묘사됩니다.
전자의 가장 바깥 층은 원자가 쉘로 알려져 있습니다. 원자가 쉘 전자는 결합에 대한 요소의 친화력을 결정합니다. 원자가 껍질이 가득 차면 일반적으로 전자가 안정하다는 좋은 지표입니다. 밸런스 쉘과 관련하여 마법의 숫자는 숫자 8입니다. 대부분의 요소는 옥트 규칙을 따릅니다. 즉, 요소가 안정되기 위해서는 가장 바깥 에너지 수준에서 8 개의 전자가 필요하다는 것을 의미합니다.
.*주기 테이블의 모든 요소에 대해 옥트 규칙이 사실이 아닙니다.
서브 쉘
에너지 수준은 서브 쉘로 분리됩니다. 각 에너지 수준에는 특정 수의 서브 쉘이 포함됩니다. 서브 쉘은 각 전자 쉘 내에서 작은 부품입니다. 가장 일반적이며 처음 네 개의 서브 쉘은 S, P, D 및 F.
입니다.우리는 주요 양자 수가 증가 할 때 각 전자 쉘이 자체 에너지 수준을 가지고 있음을 알고 있기 때문에 에너지 수준이 증가합니다. 이것은 쉘 내의 각 서브 쉘마다 동일합니다. 서브 쉘 F는 d, p 및 s보다 에너지 수준이 가장 높습니다. 전자 쉘 중 하나의 각 서브 쉘은 그 위의 쉘보다 낮은 에너지 레벨을 갖습니다. 따라서 에너지 레벨 3의 서브 쉘은 에너지 레벨 4의 에너지보다 낮은 에너지를 갖습니다.
궤도
BOHR 모델의 결함 중 하나는 원형 궤도에서 원자의 핵 주위를 주위로 이동하는 전자의 묘사입니다. 전자는 언제라도 전자 구름 내부에있을 수 있습니다. 궤도는 S, P, D, f. 이러한 각 궤도는 다르게 형성되며 전자가 핵 주위에 떠있는 방식을 나타냅니다.
*궤도의 정의는 전자가 95 %를 찾을 수있는 공간의 정의 된 영역입니다.
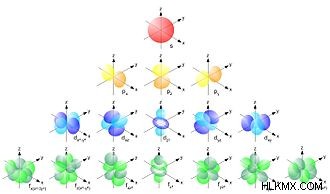
위에서 볼 수 있듯이 S 궤도에는 하나의 구형 궤도가있을 수 있지만 P 서브 쉘에는 3 개의 아령 모양의 궤도가 있습니다.
전자 구성
전자 구성이라고 알려진 것을 사용하여 전자가 분자 또는 원자의 위치를 나타내는 것입니다. 전자 구성은 어떤 에너지 레벨, 서브 쉘 및 그 서브 쉘을 차지하는 전자 수를 알려줍니다.

위 그림의 전자 구성은 전자가 S 서브 쉘의 에너지 레벨 1에 두 개의 전자 만 갖추고 있음을 알려줍니다.