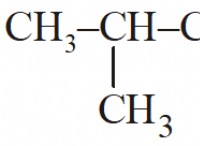이온 성 대 공유 결합 :두 명소의 이야기
이온 성 및 공유 결합은 둘 다 분자 또는 화합물을 형성하기 위해 원자를 함께 유지하는 화학적 결합의 유형입니다. 그러나 그들이이 결합을 달성하는 방법은 근본적으로 다릅니다.
이온 결합 :
* 형성 : 금속 원자 가 기증 할 때 발생합니다 비금속 원자에 전자. 이 전달은 반대로 하전 된 이온을 만듭니다 :양으로 하전 된 양이온 (금속) 및 음으로 하전 된 음이온 (비금속).
* 매력의 본질 : 이 반대로 하전 된 이온들 사이의 강한 정전기 인력은 이온 결합을 형성한다.
* 속성 :
* 높은 용융 및 끓는점 : 강한 정전기력으로 인해.
* 고체 상태 : 일반적으로 정기적 인 이온 배열로 결정질 구조를 형성합니다.
* 전기를 전환 : 물에 용해되거나 녹을 때, 유리 이온은 전기를 움직이고 전도 할 수 있습니다.
* 부서지기 : 이온의 엄격한 배열은 부서지기 쉬우 며 산산이 부서지기 쉽습니다.
* 예 : NaCl (테이블 소금), KBR, CAO
공유 결합 :
* 형성 : 2 개의 비금속 원자가 공유 할 때 발생합니다 하나 이상의 전자 쌍. 이 공유는 두 원자 모두에 대한 안정적인 전자 구성을 만듭니다.
* 매력의 본질 : 공유 전자는 두 원자의 핵에 끌려 강한 공유 결합을 만듭니다.
* 속성 :
* 낮은 용융 및 끓는점 : 이온 결합에 비해 공유 결합이 약합니다.
* 가스, 액체 또는 고형물 : 공유 화합물은 결합의 강도에 따라 다양한 상태에 존재할 수 있습니다.
* 가난한 도체 : 자유 이온이 없기 때문에 일반적으로 전기 도체가 좋지 않습니다.
* 유연성 : 결합의 방향성 특성으로 인해 유연하거나 가단성이있을 수 있습니다.
* 예 : H₂O (물), Co₂ (이산화탄소), Ch₄ (메탄)
다음은 주요 차이점을 요약 한 표입니다.
| 기능 | 이온 결합 | 공유 본드 |
| ---------------------------------------------------------------------------------------------- |
| 형성 | 전자 전송 | 전자 공유 |
| 매력의 본질 | 정전기 | 공유 전자 인력 |
| 용융/끓는 지점 | 높은 | 더 낮은 |
| 상태 | 솔리드 (수정) | 가스, 액체 또는 고체 |
| 전도도 | 솔루션/용융물의 좋은 지휘자 | 불쌍한 지휘자 |
| 예 | NaCl, Kbr, Cao | H₂O, Co₂, Ch₄ |
키 테이크 아웃 : 주요 차이점은 전자가 관여하는 방식에 있습니다. 이온 결합은 전자의 전달을 포함하여 유치하는 하전 된 이온을 만듭니다. 공유 결합은 전자 공유를 포함하여 두 원자에 대한 안정적인 전자 구성을 생성합니다.