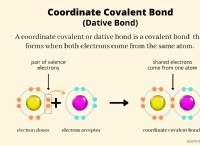
* 산 용액에서 7 미만의 pH 및 방출 수소 이온 (H+)을 갖습니다.
* 베이스 용액에서 7보다 큰 pH 및 수산화 이온 (OH-)을 방출합니다.
이 문제에 접근하는 방법은 다음과 같습니다.
1. 산성 및 기본 솔루션을 식별하십시오 : 이를 위해서는 질문에 제공된 특정 솔루션이 필요합니다. 예를 들어, 염산 (HCL), 수산화 나트륨 (NAOH) 또는 식초 (아세트산)와 같은 용액이있을 수 있습니다.
2. 산과 염기의 강도를 고려하십시오 : 더 강한 산 및 염기는 혼합물의 pH에 더 큰 영향을 미칩니다.
3. 혼합물의 pH를 예측한다 :
* 두 용액이 모두 산성이라면 혼합물도 산성입니다.
* 두 솔루션이 기본적이면 혼합물도 기본적입니다.
* 한 용액이 산성이고 다른 용액이 기본이면 혼합물의 pH는 산 및 염기의 상대 강도에 의존합니다. 더 강한 솔루션은 pH에 더 큰 영향을 미칩니다.
예 :
다음 솔루션이 있다고 가정 해 봅시다.
* 용액 A :염산 (HCL) - 강산
* 용액 B :중탄산 나트륨 (NAHCO3) - 약한 염기
혼합 될 때, HCl (강산)은 반응을 지배하여 혼합물 산성 를 만듭니다. .
특정 솔루션을 알지 못하면 결정적인 답변을 제공 할 수 없습니다. 고려하고 싶은 솔루션 쌍을 제공하고 산도를 결정하는 데 도움을 드리겠습니다.