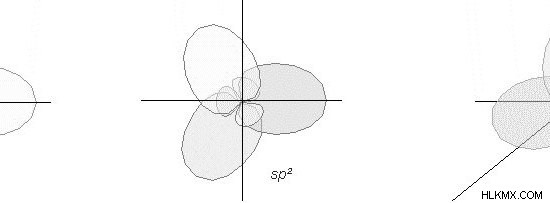
주요 차이 - VSEPR 대 원자가 본드 이론
vsepr and kalence bond 이론은 공유 화합물의 특성을 설명하는 데 사용되는 화학의 두 가지 이론입니다. VSEPR 이론은 분자에서 원자의 공간 배열을 설명합니다. 이 이론은 특정 분자의 모양을 예측하기 위해 고독한 전자 쌍과 결합 전자 쌍 사이의 반발을 사용합니다. 원자가 결합 이론은 원자 사이의 화학적 결합을 설명합니다. 이 이론은 시그마 본드 또는 PI 결합을 형성하기 위해 궤도의 겹치는 것을 설명합니다. VSEPR과 원자가 결합 이론의 주요 차이점은 VSEPR이 분자의 형상을 설명하는 반면, 원자가 굽힘 이론은 분자의 화학적 결합을 설명한다는 것입니다 .
주요 영역을 다루었습니다
1. VSEPR 이론
- 정의, 설명, 예제가있는 응용 프로그램
2. 원자가 본드 이론이란?
- 정의, 설명, 예제가있는 응용 프로그램
3. VSEPR과 밸런스 본드 이론의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :공유 결합, 기하학, 혼성화, PI 결합, 시그마 본드, 밸런스 본드 이론, VSEPR 이론 
vsepr 이론
vsepr 또는 밸런스 쉘 전자 쌍 반발 이론 분자의 형상을 예측하는 이론입니다. VSEPR 이론을 사용하여 공유 결합 또는 조정 결합을 갖는 분자에 대한 공간 배열을 제안 할 수 있습니다. 이 이론은 원자의 원자가 껍질의 전자 쌍 사이의 반발에 기초합니다. 전자 쌍은 두 가지 유형으로 본드 쌍과 고독한 쌍으로 발견됩니다. 이 전자 쌍 사이에는 세 가지 유형의 반발이 있습니다.
- 본드 페어 - 본드 쌍 반발
- 본드 페어 - 고독한 쌍 반발
- lone 쌍 - 고독한 쌍 반발
이러한 반발은이 모든 쌍이 전자 쌍이기 때문에 발생합니다. 그들은 모두 부정적인 기소가 있기 때문에 서로 격퇴합니다. 이러한 반발은 동일하지 않다는 점에 유의해야합니다. 고독한 쌍에 의해 생성 된 반발은 본드 쌍의 반발보다 높다. 다시 말해, 고독한 쌍은 본드 쌍보다 더 많은 공간이 필요합니다.
- 고독한 쌍에 의한 반발> 본드 쌍에 의한 반발
VSEPR 이론은 전자 형상과 분자 형상을 예측하는 데 사용될 수 있습니다. 전자 형상은 존재하는 고독한 쌍을 포함하는 분자의 형상이다. 분자 형상은 결합 전자 쌍 만 고려한 분자의 모양입니다.
다음 형태는 VSEPR 이론을 사용하여 얻을 수있는 분자의 기본 형태입니다.
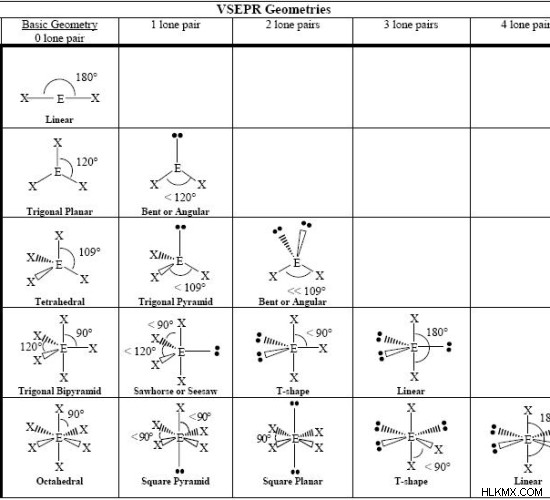
그림 1 :분자 형상 표
분자의 형상은 중앙 원자 주위의 결합 쌍과 고독한 쌍의 수에 의해 결정됩니다. 중심 원자는 종종 분자에 존재하는 다른 원자 중에서 가장 전기 음성 원자입니다. 그러나, 중심 원자를 결정하는 가장 정확한 방법은 각 원자의 상대적인 전기성을 계산하는 것입니다. 두 가지 예를 고려해 봅시다.
- Becl 2 (베릴륨 클로라이드)
중앙 원자는
2 개의 원자가를 가지고 있습니다.
cl 원자는 원자 당 하나의 전자를 공유 할 수 있습니다.
따라서 중앙 원자 =2 (BE) + 1 × 2 (Cl atoms에서) =4
따라서, Atom =4 /2 =2
의 수는 Atom =4 /2 =2
에 존재합니다. =2 - 2 =0
그러므로 BECL2 분자의 형상은 선형입니다.
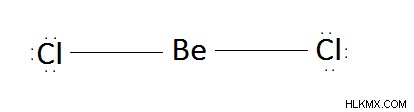
그림 2 :Becl 2 의 선형 구조 분자
- h 2 o 분자
중앙 원자는 O. /> O =2
주위에 존재하는 단일 결합의 수, 따라서 H2O의 기하학은 각도입니다.
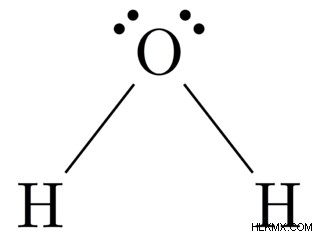
그림 3 :h 2 의 기하학 o 분자
위의 두 예를 살펴보면 두 분자는 3 개의 원자로 구성됩니다. 두 분자는 2 개의 단일 공유 결합을 갖는다. 그러나 형상은 서로 다릅니다. 그 이유는 h 2 때문입니다 O에는 2 개의 고독한 쌍이 있지만 becl 2 고독 쌍이 없습니다. O 원자의 고독한 쌍은 결합 전자 쌍을 반발시킨다. 이 반발은 두 채권이 서로 가까이 오게합니다. 그러나 두 개의 결합 쌍 사이의 반발로 인해 매우 가까워 질 수 없습니다. 즉, O 원자 주위의 전자 쌍 사이에는 순 반발이 있음을 의미합니다. 이것은 선형 분자보다는 각도 형태의 분자를 초래합니다. becl 2 에서 분자, 고독한 쌍이 없기 때문에 고독한 쌍으로 인해 반발이 발생하지 않습니다. 따라서 결합 쌍의 반발 만 발생하고 결합은 최소 반발이 발생하는 가장 먼 위치에 있습니다.
원자가 본드 이론이란 무엇입니까
밸런스 본드 이론은 공유 화합물의 화학적 결합을 설명하는 이론입니다. 공유 화합물은 공유 결합을 통해 서로 결합 된 원자로 구성됩니다. 공유 결합은 두 원자 사이의 전자 공유로 인해 형성된 화학적 결합의 유형이다. 이 원자들은 궤도를 채우고 안정적이되기 위해 전자를 공유합니다. 원자에 짝을 이루지 않은 전자가 있으면 전자가 쌍을 이루는 원자보다 덜 안정적입니다. 따라서, 원자는 모든 전자를 짝을 이루기 위해 공유 결합을 형성합니다.
원자에는 껍질에 전자가 있습니다. 이 껍질은 s, p, d 등과 같은 서브 쉘로 구성됩니다. s 하위 쉘을 제외하고 다른 서브 쉘은 궤도로 구성됩니다. 각 하위 쉘의 궤도 수는 다음과 같습니다.
| sub-shell | 궤도 수 | 궤도 이름 |
| s | 0 | - |
| p | 3 | p x , p y , p z |
| d | 5 | d xz , d xy , d yz , d x2y2 , d z2 |