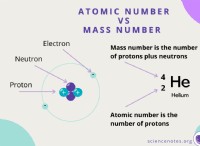
fe (OH) ₃ (S) + 3Cl⁻ (aq) ⇌ [fecl₃] ⁻ (aq) + 3oh⁻ (aq)
이 반응은 사트라 클로로로 레이트 (III) 음이온 ([Fecl₄] ⁻) 의 형성을 나타낸다 , 가용성 복합체 이온. 반응은 평형 반응으로 양방향으로 진행될 수 있습니다.
여기에 무슨 일이 일어나고 있는지
* 클로라이드 이온 (cl⁻) 고체 수산화철 (Fe (OH) ₃) 와 반응합니다 .
* 클로라이드 이온은 철 (III) 중심으로부터 수산화 이온 (OHA)을 대체하여 사트라 클로로로 페라 레이트 (III) 음이온 ([Fecl₄] ⁻) 를 형성한다. .
*이 복잡한 이온은 가용성 입니다 물에서, 수산화 제 2 철 용해 의 용해 .
* 히드 록 사이드 이온 (OH태) 용액으로 방출 된 것은 pH 를 증가시킨다 , 더 알칼리성을 만들었습니다.
반응에 영향을 미치는 요인 :
* 클로라이드 이온의 농도 : 더 높은 클로라이드 농도는 사트라 클로로로 페르 레이트 (III) 음이온의 형성을 선호하여 침전물의 더 많은 용해를 초래한다.
* 용액의 pH : 더 낮은 pH 값 (더 산성)은 수산화철의 형성을 선호하는 반면, 더 높은 pH 값 (더 많은 알칼리성)은 사트라 클로로로 페라 레이트 (III) 음이온의 형성을 선호 할 것이다.
시사점 :
*이 반응은 철 화합물의 용해도를 이해하는 데 중요합니다. 클로라이드 이온의 존재하에.
* 또한 철 (III) 수산화물 침전물이 염화물 이온을 함유하는 용액에 용해 될 수있는 이유를 설명합니다.
*이 반응은 수처리 를 포함한 다양한 응용 분야에서 관련이 있습니다. , 염화물 농도 및 pH를 조정함으로써 철 (III)의 용해가 제어 될 수있다.
전반적으로, 갓 침전 된 수산화철과 클로라이드 이온 사이의 반응은 가용성 사트라 클로로로 페르 레이트 (III) 복합체 이온의 형성을 초래하여 침전물의 용해 및 용액의 pH의 변화를 초래한다.