1. 전자 구성 :
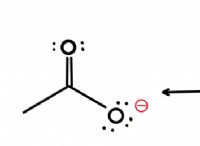
* 모든 알칼리성 지구 금속에는 2 개의 원자가 전자 (가장 바깥 쪽 쉘에 전자)가 있습니다. 이 구성은 * ns² *로 표시됩니다. 여기서 * n *는 주요 양자 수입니다. 예를 들어, 마그네슘 (mg)에는 구성 [NE] 3S²가 있습니다.
*이 유사한 외부 쉘 구성은 공유 속성의 주요 이유입니다.
2. 금속 결합 :
* 두 원자가 전자는 비교적 느슨하게 고정되어 있습니다. 이를 통해 금속 결합에 쉽게 참여할 수 있습니다.
* 금속 결합은 긍정적으로 하전 된 금속 이온과 비편정 전자의 "바다"사이의 강력한 인력입니다. 이것은 왜 열과 전기의 좋은 지휘자인지 설명합니다.
3. 반응성 :
* 알칼리성 지구 금속은 알칼리 금속보다 약간 덜 반응하지만 반응성이 높습니다. 안정적인 +2 이온을 형성하기 위해 두 개의 원자가 전자를 쉽게 잃어 버리기 때문입니다.
* 가장 바깥 쪽 전자가 핵에서 더 멀리 있고 단단히 고정되어 있기 때문에이 반응성은 그룹을 아래로 이동함에 따라 증가합니다.
4. 물리적 특성 :
* 모든 알칼리성 지구 금속은 실온에서 은빛 흰색, 광택 고체입니다.
* 비교적 부드럽지만 알칼리 금속보다 단단합니다.
* 전이 금속에 비해 녹는 점과 끓는점이 낮습니다.
요약 :
유사한 전자 구성, 금속 결합 및 원자가 전자를 잃는 용이성의 조합은 알칼리성 지구 금속의 공유 특성으로 이어집니다.