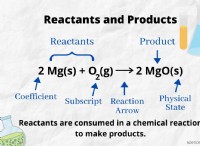
1. HCL은 물에 용해된다
* 극성 : 물 (HATER)은 극성 분자이며, 이는 약간 양의 말단 (수소 원자)과 약간 음의 말단 (산소 원자)을 갖는다는 것을 의미한다. HCl은 또한 극성 분자이며, 수소 원자는 부분 양전하 및 염소 원자는 부분 음전하를 갖는다.
* 매력 : 물 분자의 양의 말단은 HCl의 음성 염소 원자를 끌어 들이고, 물의 음성 말단은 HCl의 양성 수소 원자를 끌어냅니다.
* 해리 : 이 매력은 HCL 분자가 이온으로 분리 (해리)를 분해하게합니다.
* h⁺ (aq) : 수소 이온 (양성자)
* cl⁻ (aq) : 클로라이드 이온
2. 전자의 역할
* 전자가 전달됩니다 : HCl 분자에서 수소와 염소 원자 사이에 공유 된 전자는 본질적으로 염화물 이온 (CL)을 생성한다.
* 수소 이온 형성 : 수소 이온 (H)은 단지 양성자 일뿐입니다. 이는 전자 유일한 전자를 잃었습니다.
3. 수화
* 물 분자 서라운드 이온 : 새로 형성된 이온 (H⁺ 및 Cl⁻)은 물 분자로 둘러싸여 있습니다. 이것을 수화라고합니다.
* 안정화 : 물 분자는 전하와 상호 작용함으로써 이온을 안정화시켜 HCL로 다시 집합하는 것을 방지합니다.
요약
요컨대, HCL이 물에 용해 될 때 :
* 물의 극성 특성은 HCL이 이온으로 분리되도록합니다.
* 전자는 수소 원자에서 염소 원자로 옮겨져 염화물 이온 (Cl⁻)과 수소 이온 (H⁺)을 생성합니다.
*이 이온은 물 분자로 둘러싸여 안정화됩니다.
중요한 참고 : H⁺에 대한 "양성자"라는 용어는 약간의 지나치게 단순화된다. 실제로, 양성자는 즉시 수 분자와 결합하여 히드로 늄 이온 (H₃O⁺)을 형성한다. 그러나, 전자 전달의 개념과 이온의 생성은 동일하게 유지된다.