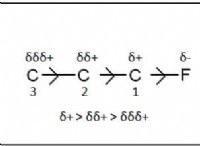
과정 이해
* 등온선 : 온도는 공정 (100 ° C) 전반에 걸쳐 일정하게 유지됩니다.
* 가역어 : 프로세스는 시스템이나 주변 환경의 순 변화없이 되돌릴 수있는 방식으로 발생합니다. 이것은 시스템이 항상 주변 환경과 평형 상태임을 의미합니다.
주요 개념
* 기화의 엔탈피 (ΔHVAP) : 1 몰의 액체가 끓는점에서 기화 될 때 열량이 흡수됩니다. 이 경우 ΔHVAP =40.656 kJ/mol.
* 작업 (W) : 가역적 프로세스의 경우, 수행 된 작업은 압력 -볼륨 변화의 네거티브와 동일합니다 :w =-pΔv.
* 열역학의 첫 번째 법칙 : ΔU =Q + W, 여기서 ΔU는 내부 에너지의 변화, Q는 열이며 W는 작동합니다.
* 내부 에너지 변화 (ΔU) : 등온 과정의 경우 ΔU =0 (내부 에너지는 온도에만 의존하기 때문에).
계산
1. 열 (Q) : 응축이 기화의 역전이기 때문에 방출 된 열은 기화 엔탈피의 음의와 동일합니다.
q =-Δhvap =-40.656 kj/mol
2. 작업 (W) : 열역학의 첫 번째 법칙과 ΔU =0 :
0 =q + w
w =-q =40.656 kj/mol
요약
* 작업 (W) : 40.656 kj/mol
* 열 (Q) : -40.656 kj/mol
중요한 메모
* 서명 컨벤션 : 시스템에 의해 수행 된 작업은 부정적인 것으로 간주되며 시스템에서 수행 된 작업은 긍정적입니다. 시스템에 의해 흡수되는 열은 양수이며 시스템에 의해 방출되는 열은 음수입니다.
* 이상적인 가스 가정 : 우리는 수증기가 이상적으로 행동한다고 가정하여 압력, 부피 및 온도의 관계를 사용할 수 있습니다.
이 과정의 다른 측면을 탐색하거나 추가 질문이 있으시면 알려주십시오!