산화 칼슘으로 염산의 중화
염산 (HCL)과 산화 칼슘 (CAO) 사이의 반응은 중화 반응으로 염화 칼슘 (CaCl₂)과 물 (HATE)을 생성합니다.
반응 방정식 :
2 HCL (AQ) + CAO (S) → CACLA (AQ) + HATER (L)
설명 :
* 염산 (HCl) : 강산은 용액에서 수소 이온 (H⁺)을 쉽게 방출한다는 것을 의미합니다.
* 산화 칼슘 (CAO) : 기본 산화물은 물과 반응하여 염기 (수산화 칼슘, 캘리포니아 (OH) ₂)를 형성하여 산을 중화시킨다.
* 클로라이드 칼슘 (Cacl₂) : 산 및 염기의 반응으로 형성된 염. 그것은 물에 용해됩니다.
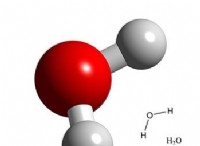
* 물 (h>o) : 반응의 다른 생성물은 산 및 수산화물 이온으로부터의 수소 이온의 조합에 의해 형성된 반응의 다른 생성물.
반응과 관련된 단계 :
1. 산화 칼슘은 물과 반응합니다 : cao (s) + h so (l) → ca (OH) ₂ (aq)
2. 수산화 칼슘은 염산을 중화시킨다 : ca (OH) ₂ (aq) + 2 HCl (aq) → CaCl₂ (aq) + 2 h₂o (l)
전반적으로 :
이 반응은 발열이므로 열이 방출됩니다. 반응은 또한 강산 (HCl)이 염 (CaO)에 의해 중화되어 염 (CaCl₂) 및 물 (HATE)에 의해 중화되는 산-염기 반응의 전형적인 예이다.
응용 프로그램 :
이 반응은 다음을 포함하여 다양한 응용 분야에서 일반적으로 사용됩니다.
* 산업 공정 : 산성 폐기물 스트림을 중화합니다.
* 수처리 : 물의 pH를 조정합니다.
* 건축 : 시멘트와 박격포의 구성 요소로.
안전 예방 조치 :
* 염산은 부식성이고 유해합니다. 주의해서 다루고 적절한 보호 장비를 착용하십시오.
* 산화 칼슘은 물과 격렬하게 반응하여 열을 발생시킵니다. 취급 할 때주의를 기울이십시오.