1. Molarity (m) :
* 정의 : 용액 리터당 용질의 두부 (mol/L).
* 예 : NaCl의 1m 용액은 1 리터의 용액에 용해 된 1 몰의 NaCl을 함유한다.
* 사용 : 화학량 론적 계산, 적정 및 두더지와 관련된 반응.
2. Molality (m) :
* 정의 : 용매 킬로그램 당 용질의 두부 (mol/kg).
* 예 : NaCl의 1m 용액은 1 kg의 물에 용해 된 1 몰의 NaCl을 함유한다.
* 사용 : 몰리가 온도와 무관하므로 온도 변화가 부피에 영향을 줄 수있는 솔루션.
3. 질량 백분율 (%) :
* 정의 : 용질의 질량을 용액의 질량으로 나눈 값은 100%를 곱한다.
* 예 : 10% NaCl 용액은 용액 100g 당 10g의 NaCl을 함유한다.
* 사용 : 종종 일상 솔루션에 사용되는 단순하고 직접 농도를 측정합니다.
4. 백만 분당 부품 (ppm) :
* 정의 : 용액 (mg/l) 당 용질 밀리그램.
* 예 : 물에 10 ppm의 염소 용액은 물 1 리터당 10mg의 염소를 함유합니다.
* 사용 : 환경 모니터링 및 추적 분석에서 종종 발견되는 매우 희석 된 솔루션.
5. 정규성 (n) :
* 정의 : 용액 리터당 용질의 그램 동등한 가중치의 수.
* 예 : H2SO4의 1 N 용액은 용액 (49 g/L)의 리터당 1 그램 등가 중량의 H2SO4를 함유한다.
* 사용 : 등가 지점을 포함하는 산-염기 반응 및 적정.
6. 몰 분획 (χ) :
* 정의 : 용질의 두부는 용액의 모든 성분의 총 두더지로 나눈 값입니다.
* 예 : NaCl에 대해 두더지 분율이 0.2 인 용액은 용액의 총 두더지의 20%가 NaCl임을 의미합니다.
* 사용 : 열역학적 계산 및 위상 평형.
7. 부피 백분율 (v/v) :
* 정의 : 용질의 부피를 총 용액의 부피로 나눈 값은 100%를 곱한다.
* 예 : 20% (v/v) 에탄올 용액은 100 mL의 용액 중에 20 mL의 에탄올을 함유한다.
* 사용 : 용질 및 용매가 액체 인 용액.
8. 다른 단위 :
* 밀도 : 단위 부피당 질량, 다른 용액의 농도를 비교하는 데 유용합니다.
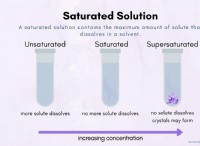
* 포화 : 특정 온도에서 주어진 용매에 용해 될 수있는 최대 용질의 양을 설명합니다.
농도 단위의 선택은 특정 응용 분야 및 솔루션의 특성에 따라 다릅니다. 정확한 계산 및 표현을 위해 적절한 단위를 선택하는 것이 중요합니다.