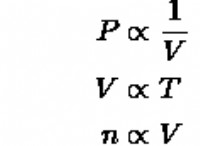재료 :
* 마그네슘 리본 (작은 조각)
* 희석 염산 (HCL)
* 비이커
* 물
* 테스트 튜브
절차 :
1. 솔루션 준비 :
* 하나의 테스트 튜브를 희석 한 염산으로 채 웁니다.
* 다른 테스트 튜브를 순수한 물로 채 웁니다.
2. 마그네슘을 첨가 :
* 작은 마그네슘 리본 조각을 산과 테스트 튜브에 조심스럽게 떨어 뜨립니다.
* 다른 작은 마그네슘 리본 조각을 물로 테스트 튜브에 떨어 뜨립니다.
3. 관찰 :
* 산 : 산 용액의 마그네슘 리본에 거품이 빠르게 형성되는 것을 볼 수 있습니다. 마그네슘은 반응함에 따라 사라지기 시작합니다. 해결책은 약간 따뜻할 수 있습니다.
* 물 : 물에서 눈에 띄는 반응은 거의 없을 것입니다. 마그네슘은 약간 둔 해 보일 수 있지만 산에서는 활발한 버블 링이 없을 것입니다.
설명 :
* 산과 마그네슘 : 마그네슘이 산과 같은 산과 반응하면 단일 변위 반응을 겪습니다. 마그네슘은 수소보다 반응성이 높으므로 산에서 수소를 대체하여 염화 마그네슘을 형성하고 수소 가스를 방출합니다. 수소 가스는 거품으로 보는 것입니다.
* 물과 마그네슘 : 마그네슘은 물과 매우 느리게 반응합니다. 물은 매우 약한 산이기 때문입니다. 반응이 발생하는 동안 정상적인 조건에서는 속도가 매우 느립니다.
안전 예방 조치 :
* 산을 다룰 때 항상 안전 고글을 착용하십시오.
*주의해서 산을 다루십시오. 피부에 산이 쏟아지면 물로 즉시 씻으십시오.
*이 실험은 환기가 잘되는 지역에서 실험을 수행하십시오.
당신이 보는 것과 그것이 의미하는 바 :
* 산에 마그네슘의 빠른 버블 링 및 용해는 반응이 물보다 훨씬 빠르다는 것을 보여줍니다.
* 물에 상당한 반응이 부족하면 마그네슘이 순수한 물에 훨씬 느리게 반응 함을 확인합니다.
이 실험은 마그네슘이 순수한 물보다 산과 훨씬 더 빠르게 반응하여 반응을 촉진하는데 산의 중요한 역할을 강조한다는 것을 분명히 보여줍니다.