핵심 개념
이 튜토리얼에서는 3 Colligative Properties에 대해 배우게됩니다 :증기 압력 하강, 비등점 높이 및 동결 지점 우울증! 또한 내용을 이해하는 데 도움이되는 배경 정보를 배우게됩니다.
다른 기사에서 다루는 주제
- 물리적 대 화학적 특성
- 물질 상태
- 고체, 액체 및 가스의 특성
- 위상 다이어그램
공동 특성과 관련된 개념
이 주제에 대해 읽기 전에 먼저 튜토리얼을 완전히 이해하려면이 섹션을 읽고 이해해야합니다!
라울트의 법칙
François-Marie Raoult는 Fournes에서 태어난 프랑스 화학자로서“Raoult 's Law”를 만들었습니다. 이 법은 냉동 지점의 우울증과 용액의 증기 압력에 중점을 둡니다.
p (솔루션) = χ (용매) × pº (용매)
p (솔루션) - 용액의 증기 압력
χ (용매) - 용매의 몰 분율
Pº (솔벤트) - 순수한 용매의 증기압
헨리 ‘법률
윌리엄 헨리 (William Henry)는 맨체스터에서 태어난 영국 화학자였으며“헨리의 법칙”을 창설했습니다. 이 법에 따르면, 액체에 용해 된 가스의 양은 액체 위의 부분 압력에 비례합니다. 이 법에 대한 예외는 가스와 용액이 서로 화학 반응에 참여할 때입니다. 이 때문에 헨리의 법칙은 또한“제한 법”으로 알려져 있습니다.
c =k × p (가스)
C - 용해 된 가스의 농도
K - Henry의 법률 상수
p (가스) - 가스의 부분 압력
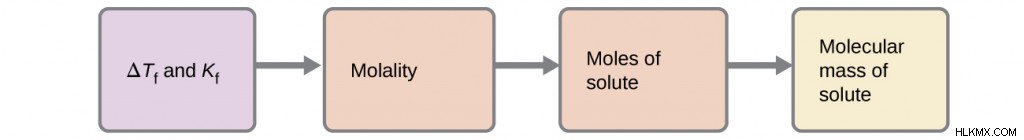
몰비 vs. 몰 리티
- Molarity (M) : 용액의 몰 농도. 공식 :m =(용질의 몰)/(용액의 리터)
- molality (m) : 물질의 몰과 용매 킬로그램의 비율. 공식 :M =(Mols solute)/ (kg of solvent)
용해도
용해도는 물질 (고체, 액체 또는 가스)이 용매에 완전히 용해되는 능력입니다. 용해도에 영향을 미치는 많은 물리적 및 화학적 요인이 있습니다.
예를 들어, pH 및 용해도는 역 관계를 갖는다; 물질의 pH가 감소하면 용해도가 증가합니다. 또한, 크기와 용해도는 직접적인 관계를 갖습니다. 입자가 작을수록 용매에 대한 표면적 노출 증가로 인해 물질이 더 빨라집니다. 다음으로, 용매와 용질의 구조는 상호 작용하는 방식에 역할을 할 수 있습니다. 그들은 함께 혼합하고 서로를 격퇴하지 않기 위해 소수성과 같은 구조적 특성을 가져야합니다. 또한 온도는 용질의 구조에 따라 다른 영향을 미칩니다. 단단하면 온도가 높을수록 더 빨리 용해됩니다. 그러나 가스의 경우 온도가 낮을수록 압력이 높아질수록 더 빨리 용해됩니다.
공동 특성이란 무엇입니까?
"Colligative"는 라틴어 "Colligatus"에서 유래 한 것입니다.
이들 특성은 물질의 농도에 의해 영향을받는 물리적 변화가있다. 다시 말해, 이들은 용질 분자 또는 이온의 몰라도 또는 몰에 의존한다. 공동 특성은 용해 된 입자의 수에만 의존하며 입자의 고유 한 정체성에 의존하지 않습니다.
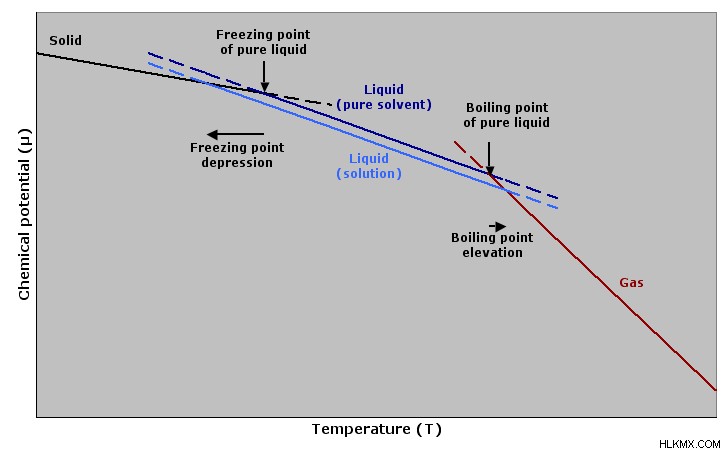
공동 특성은 여러 섹션으로 나눌 수 있으며, 증기 압력 하강, 비등점 높이 및 동결 지점 우울증 :아래 그래프 전체에서 볼 수 있습니다. 각각을 자세히 살펴 보겠습니다!
증기 압력 하강
이온 성 화합물이 용매에 첨가 될 때, 그것은 분리된다; 이런 일이 발생하면 용액의 비등점이 증가하고 동결 지점이 감소합니다. 설탕과 같은 물질의 경우, 분리되지는 않지만 여전히 끓는점이 증가하고 동결 지점이 감소합니다.
p 솔루션 =χ 용매 × p ° <서브> 용매
비등점 고도
끓는점 고도는 증기 압력 하강과 직접 관련이 있습니다. 그것은 모든 용액에서 모든 용질에 존재합니다. 다른 화합물 인 비 휘발성 용질이 용액에 첨가되고, 순수한 용질에 첨가되면, 비등점이 증가합니다. 이런 일이 발생하면 물질 액체 상 또는 기체가 에너지 측면에서 동일합니다.
Δt b = i × k b × m
Δt b =끓는점의 변화
i =VON HOFF 계수가 아닙니다
k b =몰랄 비등점 일정
m =molality
동결 지점 우울증
이 특성에서, 액체 용매 및 고체 용매는 평형에있다; 그러나 이런 일이 발생하기 전에 온도가 낮아서 동결이 발생할 수 있습니다. 이 특성의 예는 설탕이 물에 녹을 때 보편적 인 용매, 동결 지점이 낮아지고 물의 변형으로 인해 결정화를 방해하기 때문에 아이스크림입니다. 설탕 입자는 용매의 매력을 방해하고 있습니다.
∆t f =k f × m
∆t f =동결 지점의 변경
k f =몰랄 동결 지점 상수
m =molality

추가 읽기
- 화학 반응이란 무엇입니까?
- 평형 상수는 무엇입니까?
- 어금니 질량 계산
- 일반적인 이온 효과