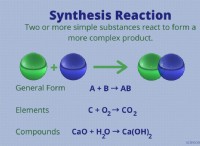
1. 용액에서의 부분 이온화 :
* 시나리오 : 물질은 물에 용해되지만 분자의 작은 비율만이 양성자 (H+)를 기증하여 하이드로 늄 이온 (H3O+)을 형성합니다.
* 예 : 아세트산 (CH3COOH)은 물에서 부분적으로 이온화되기 때문에 약한 산이다.
2. 낮은 산 해리 상수 (KA) :
* 시나리오 : 산의 이온화 반응 (KA)에 대한 평형 상수는 작으며, 이는 산이 해제되지 않은 형태로 남아 있음을 나타낸다.
* 예 : 아세트산의 KA는 1.8 x 10^-5이며, 이온화가 제한되어 있기 때문에 약한 산임을 나타냅니다.
3. 중립 근처의 pH 값 :
* 시나리오 : 물질의 용액은 7 (중립)에 가까운 pH 값을 갖는다. 이것은 H+ 이온의 농도가 비교적 낮다는 것을 의미합니다.
* 예 : 탄산산 (H2CO3)의 용액은 부분적으로 분리하기 때문에 7에 가까운 pH를 가질 것이다.
4. 제한된 양성자 기증 :
* 시나리오 : 물질에는 양성자를 기증하기가 어렵다는 구조가 있습니다. 이것은 다음과 같습니다.
* 강한 채권 : 양성자를 고정시키는 본드는 매우 강하고 파손하려면 상당한 양의 에너지가 필요합니다.
* 전자 철수 그룹 : 분자에 전자-흡인기의 존재는 양성자를 기증 할 가능성을 줄일 수있다.
* 예 : 페놀 (C6H5OH)은 방향족 고리에 부착 된 하이드 록실기 (OH)를 갖는다. 고리의 전자 흡인 특성은 페놀이 양성자를 기증하기가 더 어려워 약산으로 만듭니다.
키 테이크 아웃 :
약산은 용액에 양성자를 기증하는 제한된 능력을 특징으로한다. 이것은 낮은 이온화, 작은 KA 값, 중립에 가까운 pH 및 양성자 기증을 방해하는 구조적 특징에 반영됩니다.