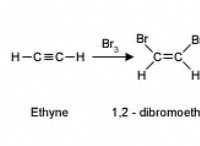
1. 용해 : 염 결정이 용액에 용해되기 시작합니다. 용액의 물 분자는 결정의 표면에서 Na+ 및 클리온을 둘러싸고,이를 당기고 결정을 함께 잡고있는 이온 결합을 깨뜨린다.
2. 평형 : 더 많은 이온이 용해됨에 따라, 용액에서 염의 농도가 증가한다. 결국, 용해 속도는 결정화 속도 (용액의 이온이 결정으로 돌아올 때)와 동일합니다. 이 시점에서 용액은 동적 평형에 도달합니다.
3. 포화 : 용액이 불포화 된 경우, 더 많은 소금을 녹일 수 있음을 의미하면 용액이 포화 될 때까지 결정이 계속 용해됩니다. 포화시, 용해 및 결정화 속도는 동일하며 용액에서의 염 농도는 일정하게 유지된다.
중요한 참고 : 용해 속도는 온도, 교반 및 결정 크기와 같은 요인에 의해 영향을받을 수 있습니다. 예를 들어, 더 높은 온도는 일반적으로 더 빠른 용해로 이어질 것입니다.
요약 : 솔트 결정은 용액이 포화에 도달 할 때까지 불포화 용액에 용해됩니다. 결정이 용해됨에 따라 용액이 더 집중 될 것입니다.