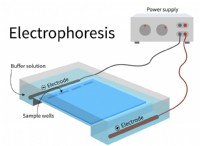
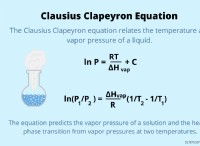
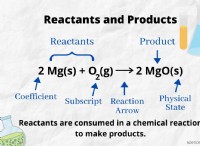
* 용해도 한계 : 아세트산은 물의 용해도가 제한되어 있습니다. 실온에서도 약 17m까지는 용해됩니다. 250m 솔루션 이이 한도를 훨씬 초과합니다.
* 실제 고려 사항 : 이러한 집중 솔루션을 만드는 것은 매우 어렵고 잠재적으로 위험 할 것입니다. 용해의 열은 중요 할 것이며, 당신은 매우 부식성이 있고 잠재적으로 폭발성 혼합물로 끝날 것입니다.
보다 현실적인 집중에 대한 계산을 살펴 보겠습니다.
약한 아세트산 용액의 pH 계산
0.25m 아세트산과 같은 더 현실적인 농도 (여전히 상당히 집중되어 있음)를 가정 해 봅시다.
pH를 계산하는 방법은 다음과 같습니다.
1. 아세트산 이해 : 아세트산 (CH3COOH)은 약산입니다. 그것은 부분적으로 단지 물에서 이온화되므로 이온으로 완전히 분해되지 않습니다 (H+ 및 CH3coo-).
2. 평형 상수 : 아세트산의 이온화는 다음 평형에 의해 설명된다.
CH3COOH (AQ) <=> H + (AQ) + CH3COO- (AQ)
이 평형은 1.8 x 10^-5 인 아세트산에 대한 산 분리 상수 (KA)를 특징으로한다.
3. 얼음 테이블 : 우리는 얼음 (초기, 변화, 평형) 테이블을 사용하여 이온의 평형 농도를 결정할 수 있습니다.
| | CH3COOH | H+ | CH3COO- |
| ----- | -------- | ----- | -------- |
| i | 0.25m | 0 | 0 |
| C | -X | +x | +x |
| e | 0.25-x | x | x |
4. ka 표현 : ka =[H+] [CH3COO-] / [CH3COOH]
1.8 x 10^-5 =(x) (x) / (0.25 -x)
5. x :의 해결 KA는 매우 작기 때문에 x <<0.25를 가정 할 수 있습니다. 이것은 방정식을 단순화합니다.
1.8 x 10^-5 =x^2 / 0.25
x^2 =4.5 x 10^-6
x =2.12 x 10^-3
6. pH : x는 [h+]를 나타내므로 pH를 찾을 수 있습니다.
pH =-log [h+] =-log (2.12 x 10^-3) ≈ 2.67
중요한 참고 :
* 산으로 작업 할 때는 항상 적절한 안전 조치를 사용하십시오.
* 위의 계산은 단순화입니다. 실제로, 아세트산의 이온화는 온도 및 이온 강도와 같은 인자에 의해 영향을받습니다.
다른 농도의 아세트산에 대한 pH 계산을 탐색하고 싶다면 알려주십시오.