1. 원자가 전자를 결정하십시오 :
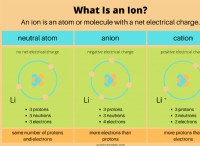
* 칼슘 (ca) : 그룹 2이므로 2 개의 원자가 전자가 있습니다.
* 산소 (O) : 그룹 16이므로 6 개의 원자가 전자가 있습니다.
2. 루이스 구조를 그리십시오 :
* 칼슘 (ca) : CA :(2 개의 원자가 전자를 나타내는 두 개의 점)
* 산소 (O) : :O :(6 개의 원자가 전자를 나타내는 6 개의 점)
3. 옥넷 규칙 달성 :
* 산소는 전체 낙지 (8 전자)를 달성하기 위해 2 개의 전자를 얻기를 원합니다.
* 칼슘은 안정적인 전자 구성을 달성하기 위해 두 개의 전자를 잃고 싶어합니다.
4. 화합물을 형성하십시오 :
칼슘은 2 개의 원자가 전자를 잃고 산소는 2 개의 원자가 전자가 필요하기 때문에 1 :1 비율로 결합합니다.
* 칼슘 (Ca)은 2 개의 전자를 잃어 +2 양이온 (Ca²⁺)
* 산소 (O)는 2 개의 전자를 -2 음이온 (O²⁻)으로 얻습니다.
5. 화학식 :
반대로 하전 된 이온은 서로 끌어 이온 성 화합물을 형성합니다. 충전은 균형을 잡아 화학 공식을 초래합니다. cao (산화 칼슘).
산화 칼슘의 루이스 구조 (CAO) :
이온 성 화합물은 공유 화합물과 같은 전통적인 루이스 구조를 형성하지 않는 것이 중요합니다. 루이스 구조는 전자 전달 및 이온의 형성을 이해하는 데 사용됩니다.