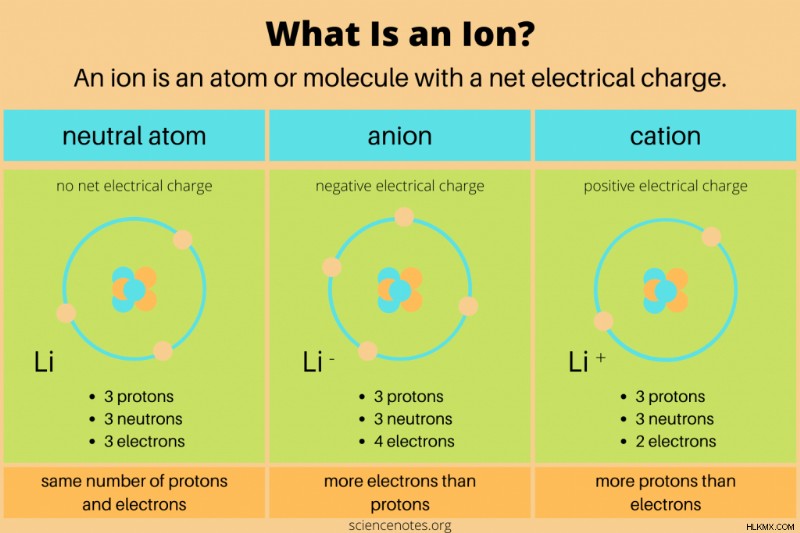
화학에서, 이온 의 정의 전기 하전 된 원자 또는 분자입니다. 이는 원자 또는 분자가 불평등 한 수의 양성자 및 전자를 가지고 있음을 의미합니다. 중성자는 순 전하를 가지고 있지 않으므로 직접 이온에 영향을 미치지 않습니다. 화학 반응에서, 원자 또는 분자가 원자가 전자를 얻거나 잃을 때 이온이 형성됩니다. 원자력만이 화학 종의 양성자 수를 변화시킵니다.
음이온 및 양이온
두 가지 유형의 이온은 음이온과 양이온입니다.
- 음이온 순 음성 전하가 있습니다. 그것은 양성자보다 더 많은 전자를 함유하고 있습니다. 예를 들어, 17 개의 양성자 및 18 개의 전자 (CL)를 갖는 염소 원자는 음이온이다. 음이온은 추가 전자 쉘을 얻는 경우 원래 원자보다 클 수 있습니다.
- a 양이온 순 양의 전하가 있습니다. 전자보다 더 많은 양성자가 포함되어 있습니다. 예를 들어, 하나의 양성자 및 제로 전자 (H)를 갖는 수소 이온은 양이온이다. 더 큰 핵 전하가 전자를 더 가깝게 끌어 들이기 때문에 양이온은 원래 원자보다 작습니다.
양이온 및 음이온 정의를 기억하는 한 가지 방법은 "+"부호와 같은 양이온의 "t"를 생각하는 것입니다. 또 다른 옵션은“음이온”을“음성 이온”과 같은 소리로 기억하는 것입니다.
그들은 반대 전기 전하를 가지고 있기 때문에 음이온과 양이온이 서로를 매료시킵니다. 음이온은 다른 음이온을 막는 반면 양이온은 다른 양이온을 격퇴합니다. 전기 및 자기장 모두 음이온과 양이온에 영향을 미칩니다.
이온의 예
화학적 표기법은 전하가 양수 (+) 또는 음수 (-)인지 및 전하량인지를 보여주는 슈퍼 스크립트를 갖는 요소 기호 또는 화학적 공식을 따라 이온을 나타냅니다. 전하가 1 인 경우 "+"또는 "-"기호 만 나열하십시오. 다음은 몇 가지 이온 예입니다.
- h+
- ca
- fe
- fe
- cl
- p
- nh 4
- h 3 o
- hco 3
- so 4
모나상 및 다 원자 이온
하나의 원자 만 함유하는 이온은 모나토미어 이온 입니다. . 모나토미 이온의 예는 H, O 및 Cl을 포함한다. 다수의 이온을 함유하는 이온은 다 원자 이온 이다 또는 분자 이온. 다 원자 이온의 예는 암모늄이다 (NH <서브> 4 ), Hydronium (H 3 O), 염소산염 (Co
역사
이온이라는 단어는 그리스어 단어 이온에서 유래 한 것입니다 또는 ienai ,“가야한다”를 의미합니다. 영어 물리학 자이자 화학자 Michael Faraday는 1834 년에 화학 종이 한 전극에서 다른 전극으로 이동하는 방식을 설명하는 방법 으로이 용어를 만들었습니다.
.Faraday는 전극 사이의 입자의 특성을 식별하지 않았지만, 한 전극에서 금속이 용해되고 다른 전극에 침착되는 것을 보았다. 따라서 어떻게 든 전류는 물질의 움직임에 영향을 미쳤습니다.
참조
- Cillispie, Charles (ed.) (1970). 과학 전기 사전 (첫 번째 ed.). 뉴욕시 :Charles Scribner의 아들. ISBN 978-0-684-10112-5.
- James, Frank A. J. L. (ed.) (1991). Michael Faraday의 서신 . vol. 2 :1832-1840. ISBN 9780863412493.
- Knoll, Glenn F. (1999). 방사선 감지 및 측정 (제 3 판). 뉴욕 :와일리. ISBN 978-0-471-07338-3.
- 마스터 턴, 윌리엄; Hurley, Cecile (2008). 화학 :원리와 반응 . Cengage Learning. ISBN 0-495-12671-3.