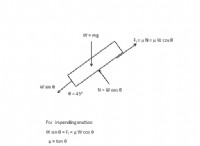
1. 활성화 에너지 및 반응 속도 :
* 활성화 에너지 : 화학 반응은 활성화 에너지라고 불리는 일정량의 에너지가 필요합니다. 이 에너지는 반응물 내의 기존 결합을 깨뜨려 새로운 결합이 제품을 형성하고 생성 할 수 있도록해야합니다.
* 열 에너지의 역할 : 열은이 활성화 에너지를 제공합니다. 분자가 열을 흡수 할 때, 그들은 더 빨리 진동하고 움직여서 활성화 장벽을 극복하기에 충분한 에너지와 충돌 가능성을 높입니다. 이것은 반응 속도의 속도를 높입니다.
2. 흡열 및 발열 반응 :
* 흡열 반응 : 이러한 반응 흡수 주변 환경에서 열. 이 제품은 반응물보다 더 높은 잠재적 에너지를 가지고 있습니다. 이것은 열 에너지가 흡수되어 본드를 깨고 새로운 결합을 형성한다는 것을 의미합니다. 예를 들어, 식물이 햇빛을 흡수하여 포도당을 생성하는 광합성이 있습니다.
* 발열 반응 : 이러한 반응 방출 주변 환경으로 가열하십시오. 제품은 반응물보다 잠재적 에너지가 낮습니다. 이는 본드가 형성 될 때 열 에너지가 방출됨을 의미합니다. 일반적인 예는 연소 연료가 열이 방출되는 연소입니다.
3. 평형 및 온도 :
* 평형 : 대부분의 화학 반응은 가역적이므로 양방향으로 진행할 수 있습니다. 평형에서, 순방향 및 역 반응의 속도는 동일하다.
* 온도의 충격 : 온도를 변경하면 평형 지점이 이동할 수 있습니다. 온도를 높이면 흡열 반응 (열을 흡수)을 선호하여 변화에 대항합니다. 반대로, 온도를 감소 시키면 발열 반응이 선호됩니다 (열 방출).
4. 예 :
* 요리 : 스토브 탑 또는 오븐에서 가열하면 식품 분자를 분해하여 구조를 반응하고 변경할 수 있습니다.
* 폭발 : 여기에는 매우 빠른 발열 반응이 포함되어 많은 양의 열과 에너지를 방출합니다.
* 살아있는 유기체의 화학 반응 : 효소, 생물학적 촉매, 종종 미묘한 열 변동을 통해 활성화 에너지를 낮추어 반응을 가속화합니다.
요약 :
열 에너지는 활성화 에너지에 영향을 미쳐 화학 반응에서 근본적인 역할을하며, 반응이 흡열인지 발열인지 여부를 결정하고 평형 조건에 영향을 미칩니다. 이 에너지는 외부 적으로 공급되거나 (용액을 가열하는 등) 반응 자체 내에서 생성 될 수 있습니다. 이 관계를 이해하는 것은 다양한 응용 분야에서 화학 반응을 제어하고 예측하는 데 필수적입니다.