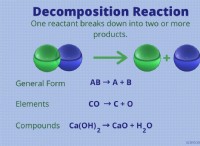
구리 이온의 역할 :
* 블루 컬러 소스 : 구리 황산염 용액의 청색은 수화 된 구리 (II) 이온 (Cu² (aq))에서 나온다. 이들 이온은 특정 파장의 빛을 흡수하여 용액이 파란색으로 나타납니다.
* 전기 분해 변화 : 전기 분해 동안, 구리 이온은 전극의 반응에 관여한다. 그러나 용액의 전체 구리 이온 수는 특히 처음에는 크게 변하지 않을 수 있습니다.
전극에서 일어나는 일 :
* 음극 (음성 전극) : 구리 이온 (Cu² ()은 캐소드에서 구리 금속 (Cu)으로 감소된다. 이것은 다음의 반 반응으로 표시됩니다.
cu²⁺ (aq) + 2e⁻ → Cu (S)
이 과정은 용액에서 구리 이온을 제거하지만 완전히 제거하지는 않습니다.
* 양극 (양의 전극) : 양극에서, 황산염 이온 (SOJET) 또는 물 분자는 산화 될 수있다. 황산염 이온이 산화되면 산소 가스와 황산을 형성합니다.
2H O (L) → O₂ (g) + 4H⁺ (aq) + 4E⁻
이 반응은 구리 이온을 직접 포함하지 않으며 청색에 큰 영향을 미치지 않습니다.
푸른 색이 남아있는 이유 :
1. 동적 평형 : 캐소드에서 구리 이온이 감소하더라도, 새로운 구리 이온이 구리 양극으로부터 지속적으로 방출되고있다. 이 동적 평형은 용액에서 구리 이온의 전체 농도를 유지하여 청색을 보존합니다.
2. 제한된 전기 분해 : 전기 분해가 매우 오랫동안 진행되지 않는 한, 용액에서 제거 된 구리 이온의 양은 초기 농도에 비해 비교적 작으므로 청색은 남아 있습니다.
푸른 색이 사라질 때 :
* 완전한 전기 분해 : 전기 분해가 충분한 시간 동안 계속되면, 용액에서 점점 더 많은 구리 이온이 제거됨에 따라 파란색이 결국 사라집니다.
* 구리 양극이 불충분합니다 : 구리 양극이 너무 작거나 완전히 소비되면 구리 이온의 공급이 고갈됨에 따라 청색이 사라집니다.
요약 : 구리 설페이트 용액의 청색은 캐소드에서의 감소와 양극으로부터 구리 용량 사이의 균형을 통해 유지되기 때문에 전기 분해 동안 남아있다. 장기 전기 분해 또는 제한된 구리 양극이있는 경우에만 푸른 색이 사라집니다.