분해 반응 4 가지 주요 화학 반응 유형 중 하나입니다. 이러한 유형의 반응을 분석 반응 또는 파괴 반응이라고도합니다. 분해 반응 정의, 반응의 예, 분해 반응을 인식하는 방법은 다음과 같습니다.
분해 반응 정의
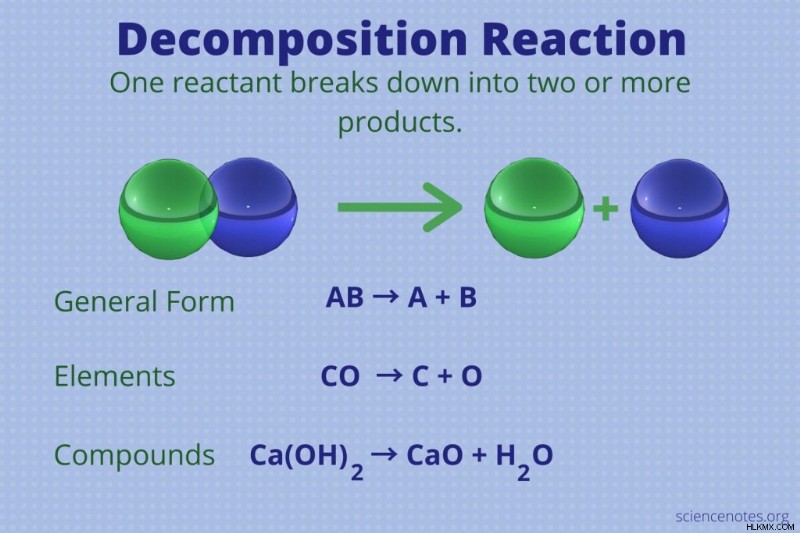
분해 반응은 2 개 이상의 생성물을 형성하는 단일 반응물과의 화학 반응입니다.
분해 반응의 일반적인 형태는 다음과 같습니다.
AB → A + B
분해 반응은 종종 순수한 요소를 포함하여 작은 분자를 형성합니다.
분해의 반대
분해 반응의 반대는 합성 반응이며, 이는 또한 조합 반응이라고도한다. 합성 반응에서, 둘 이상의 반응물이 결합되어 더 복잡한 생성물을 형성합니다.
분해 반응 예
분해 반응은 일상 생활에서 일반적입니다. 한 가지 예는 산소 가스와 수소 가스를 형성하기위한 물의 전기 분해입니다.
2 h 2 O → 2 H 2 + o 2
또 다른 예는 물과 산소를 형성하기 위해 과산화수소의 분해입니다.
2 h 2 o 2 → 2 h 2 o + o 2
청량 음료는 분해에서 탄산을 얻습니다. 탄산 산은 물과 이산화탄소로 분해됩니다.
H 2 Co 3 → h 2 O + Co 2
흡열 또는 발열?
대부분의 분해 반응은 흡열입니다. 다시 말해, 새로운 화학 결합이 생성되어 생성물을 만들기 위해 방출되는 것보다 반응물의 화학적 결합을 파괴하려면 더 많은 에너지가 필요합니다. 이러한 반응은 진행하기 위해 환경에서 에너지를 흡수합니다. 예를 들어, 수은 (II)의 산화물의 수은 및 산소로의 분해 (대부분의 금속 산화물의 분해와 같은)는 열의 입력을 필요로하고 흡열이 있습니다 :
2HGO → 2HG + O 2
그러나, 몇 가지 분해 반응은 발열이다. 그들은 흡수하는 것보다 더 많은 열을 방출합니다. 예를 들어, 질소 및 산소로의 산화 질소의 분해는 발열입니다 :
2NO → n 2 + o 2
분해 반응을 인식하는 방법
분해 반응을 식별하는 가장 쉬운 방법은 단일 반응물로 시작하여 여러 제품을 생성하는 반응을 찾는 것입니다. 또한 친숙한 사례를 인식하는 데 도움이됩니다. 금속 산화물은 금속과 산소를 형성하고, 탄산염은 일반적으로 산화물과 이산화탄소 등을 생성합니다.
분해 반응 유형
분해 반응의 세 가지 주요 유형은 열 분해, 전해 분해 및 광분해성 분해입니다.
- 열 분해 :열은 열 분해 반응을 활성화시킵니다. 이러한 반응은 흡열 인 경향이 있습니다. 예를 들어, 탄산 칼슘의 분해가 산화 칼슘과 이산화탄소를 형성하는 것입니다.
Caco 3 → Cao + Co 2 - 전해 분해 :전기 에너지는 반응물이 생성물로 분해 될 수있는 활성화 에너지를 공급합니다. 예를 들어 수소와 산소로의 물 전기 분해가 있습니다.
2H 2 O → 2H 2 + o 2 - 광분해 분해 :반응물은 빛 (광자)으로부터 에너지를 흡수하여 화학 결합을 깨고 생성물을 형성합니다. 예를 들어 산소를 형성하기위한 오존의 분해가 다음과 같습니다.
o 3 + hν → o 2 + o
촉매는 분해 반응을 도울 수있다. 이러한 반응은 촉매 분해라고합니다.
분해 반응의 사용
때때로 분해 반응은 바람직하지 않지만 몇 가지 중요한 응용 프로그램이 있습니다.
- 시멘트 및 기타 응용 프로그램을 위해 Quicklime (CAO)을 만들기 위해.
- 열 마이트 반응을 통해 용접.
- 광석, 산화물, 염화물 및 수피에서 순수한 금속을 추출합니다.
- 산 소화 불량을 치료합니다.
- 일반적으로 화합물에 결합 된 수소를 얻기 위해.
- 분해 제품에 기초한 샘플의 신원을 식별하려면.
참조
- Brown, T.L.; Lemay, H.E.; Burston, B.E. (2017). 화학 :중앙 과학 (14 번째 ed.). 피어슨. ISBN 9780134414232.
- McNaught, A.; Wilkinson, A. (1997). "화학 분해". 화학 용어의 개요 (제 2 판) (“골드 북”)”. 블랙웰 과학 간행물. doi :10.1351/goldbook.c01020