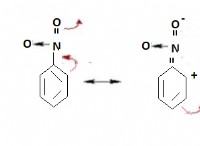
1. 이산화탄소 (CO2) 및 중탄산염 (HCO3-) 시스템 :
* 이것은 가장 중요한 입니다 자연수의 완충 시스템.
* CO2는 물에 용해되어 탄산산 (H2CO3)을 형성 한 다음 중탄산 이온 (HCO3-) 및 수소 이온 (H+)으로 분리됩니다.
*이 종들 사이의 평형은 산과 염기를 모두 중화하여 pH를 비교적 안정적인 범위 내에 유지하는 데 도움이됩니다.
2. 탄산 칼슘 (CACO3) 시스템 :
*이 시스템은 특히 하드 워터에서 중요합니다 , 칼슘과 탄산염 이온이 상당한 농도로 존재합니다.
* 탄산 칼슘은 염기로 작용하여 산을 중화시킵니다.
* 또한 탄산염 광물의 형성에 기여합니다. 버퍼 역할을 할 수 있습니다.
3. 다른 미네랄 소금 :
* 인산염, 규산염 및 황산염과 같은 다양한 용해 된 염 또한 자연수의 버퍼링에도 기여할 수 있습니다.
*이 소금은 관련된 특정 이온에 따라 산과 염기로 작용할 수 있습니다.
4. 유기 화합물 :
* 물에 용해 된 유기물 (DOM)은 또한 완충 특성을 나타낼 수 있습니다.
* 복잡한 유기 분자 인 겸자 물질은 이와 관련하여 특히 중요합니다.
5. 생물학적 과정 :
* 조류, 식물 플랑크톤 및 박테리아와 같은 살아있는 유기체는 물 화학 및 완충 용량에 영향을 줄 수 있습니다.
예를 들어, 조류는 물의 pH를 변경하여 CO2를 소비 할 수 있습니다.
버퍼링 용량에 영향을 미치는 요인 :
자연수의 버퍼링 용량은 다음과 같은 요인에 의해 영향을받습니다.
* 완충 종의 농도 : 더 높은 농도의 완충제는 일반적으로 더 큰 버퍼 용량을 초래합니다.
* 물의 pH : 버퍼링 용량은 일반적으로 버퍼링 종의 PKA 주변에서 가장 높습니다.
* 온도 : 온도는 버퍼링 반응의 평형에 영향을 줄 수 있습니다.
* 다른 용해 된 물질의 존재 : 다른 이온 또는 분자의 존재는 완충 종의 활성에 영향을 줄 수 있습니다.
다른 버퍼링 시스템의 상대적 중요성은 특정 수체의 특정 특성에 따라 다를 수 있습니다. 자연수의 완충 메커니즘을 이해하는 것은 수질을 관리하고 수생 생태계를 보호하는 데 중요합니다.