이유는 다음과 같습니다.
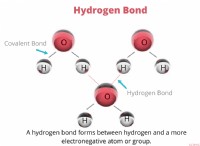
* 전자 친화력 전자가 기체 상태의 중성 원자에 첨가 될 때 에너지의 변화입니다. 보다 음의 전자 친화력은 원자가 전자를 얻는 경향이 더 크다는 것을 의미합니다.
* 전자 친화력의 경향 :
* 전자 친화력은 일반적으로 주기율표에서 (왼쪽에서 오른쪽으로) 기간에 걸쳐 증가합니다. 이것은 원자가 더 작아지고 들어오는 전자에 대한 핵의 인력이 더 강하기 때문입니다.
* 전자 친화력은 일반적으로 그룹을 감소시킵니다 (위에서 아래로). 가장 바깥 쪽 전자가 핵에서 멀어지고 덜 끌리기 때문입니다.
염소는 오른쪽에서 가장 먼 곳이며 원소 목록에서 가장 높기 때문에 전자를 얻을 가능성이 가장 높으며 가장 음의 전자 친화력이 가장 높습니다.