* 나트륨 (NA) 가장 바깥 쪽 쉘에 하나의 원자가 전자가 있습니다. 이 전자는 핵에서 상대적으로 멀리 떨어져 있으며 약한 매력을 경험합니다. 따라서 제거하기가 더 쉽습니다.
* 염소 (CL) 7 개의 원자가 전자가 있습니다. 안정적인 옥켓 구성을 달성하려면 하나 더 전자가 필요합니다. 전자를 얻는이 강력한 매력은 전자를 제거하기가 훨씬 어렵습니다.
간단한 용어로 : 나트륨은 전자가 안정되기 위해 전자를 잃고 싶어하지만 염소는 하나를 얻기를 원합니다. 이것은 염소가 전자를 잃는 것보다 훨씬 더 저항력이 있습니다.
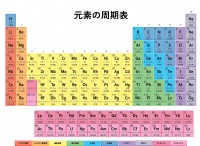
전자 친화력의 이러한 차이는 주기율표의 위치에 반영됩니다.
* 나트륨은 그룹 1 (알칼리 금속)의 금속이며 전자를 쉽게 잃습니다.
* 염소는 그룹 17 (할로겐)에서 비금속이며 전자를 쉽게 얻습니다.