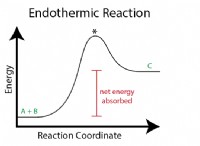
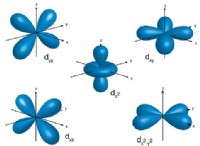
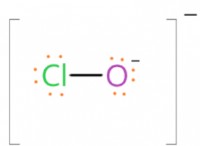이유는 다음과 같습니다.
* 나트륨 (NA) 가장 바깥 쪽 쉘에 전자가 하나뿐입니다. 이 전자는 핵에서 상대적으로 멀리 떨어져 있으며 점수가 적습니다. 따라서이 전자를 제거하는 데 에너지가 적어 이온화 에너지가 낮아집니다.
* 염소 (CL) 가장 바깥 쪽 껍질에 7 개의 전자가 있습니다. 이 전자는 핵에 더 가깝고 더 강한 매력을 경험합니다. 염소에서 하나의 전자를 제거하려면 훨씬 더 많은 에너지가 필요하므로 이온화 에너지가 더 높아집니다.
요약 : 원소의 이온화 에너지는 전자가 가장 바깥 쪽 쉘에서 제거 될 수있는 용이성과 관련이 있습니다. 단일 느슨하게 고정 된 전자를 갖는 나트륨은 염소에 비해 이온화 에너지가 낮아 전자를 더 단단히 고정시킵니다.