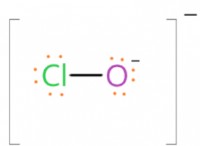1. feolaro₃의 어금니 질량을 찾으십시오 :
* Fe (철)의 몰 질량은 55.845 g/mol입니다.
* O (산소)의 몰 질량은 15.9994 g/mol입니다.
* Fe ofo₃ =(2 * 55.845 g/mol)의 몰 질량 (3 * 15.9994 g/mol) =159.69 g/mol
2. fe molo₃의 두더지를 계산하십시오 :
* 몰스 =질량 / 어금니 질량
* fe₂o of의 두더지 =14.2 g / 159.69 g / mol =0.089 mol
3. Fe :의 두더지를 결정하십시오
* 공식 Fe₂oula는 1 몰의 Fe₂O₃마다 2 몰의 Fe가 있음을 나타냅니다.
* Fe =0.089 mol fe₂o₃ * (2 mol fe / 1 mol fe₂o₃) =0.178 mol Fe의 두더지
따라서, 14.2g의 Fe₂o₃에 0.178 몰의 Fe가 존재한다. .