전자 구성 및 화학 반응성 :
원자의 전자 구성은 화학적 변화 동안 전자를 얻거나 잃는 경향을 나타내며, 가장 바깥 쪽 쉘에서 안정적인 옥셋 (8 원자가 전자)을 달성하기위한 것입니다. 방법은 다음과 같습니다.
1. 나트륨 (NA) - 전자 손실 경향 :
* 전자 구성 : 1S² 2S² 2P⁶ 3S¹
* 원자가 전자 : 1 (3S 궤도에서)
나트륨은 안정적인 옥셋을 달성하는 것과는 거리가 멀고 하나의 원자가 전자를 가지고 있습니다. 이 단일 전자를 잃고 긍정적으로 하전 된 이온 (na⁺)이되는 것이 더 쉽습니다. 이것은 두 번째 쉘에서 안정적인 옥텍의 전자 옥텍을 갖는 가장 바깥 쪽 쉘을 남겨 둡니다.
예 : 염화나트륨 (NaCl)의 형성에서 나트륨은 원자가 전자를 염소로 잃어서 안정적인 na⁺ 이온을 형성합니다.
2. 염소 (CL) - 전자를 얻는 경향 :
* 전자 구성 : 1S² 2S² 2P⁶ 3S² 3P⁵
* 원자가 전자 : 7 (3S 및 3P 궤도에서)
염소는 7 개의 원자가 전자를 가지고 있으며, 이는 안정적인 옥셋을 달성하기 위해 하나 더 필요합니다. 염소가 전자를 얻고 음으로 하전 된 이온 (Cl⁻)이되는 것이 더 쉽습니다.
예 : 염화나트륨 (NaCl)의 형성에서 염소는 나트륨으로부터 전자를 얻어 안정적인 클로 이온을 형성한다.
요약 :
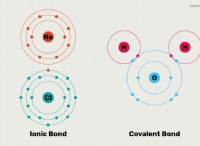
* 원자가 전자 (나트륨과 같은)가 적은 원자 (나트륨과 같은)는 안정적인 옥셋을 달성하기 위해 전자를 잃고 양이온 (양으로 하전 된 이온)이됩니다.
* 거의 완전한 원자가 껍질 (염소와 같은)을 갖는 원자는 안정적인 옥셋을 달성하고 음이온 (음의 하전 이온)이되기 위해 전자를 얻는 경향이 있습니다.
전자를 얻거나 잃는 경향은 화학 반응을 유발하여 이온 성 화합물의 형성으로 이어지고 반대로 하전 된 이온이 안정적인 구조를 유치하고 형성합니다.