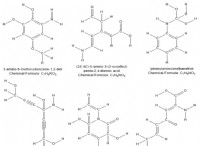
주요 측면에 대한 분석은 다음과 같습니다.
반응 1 :철 (III) 설페이트 (Fe₂ (So₄) ₃) 의 형성
주요 반응은 황산에서 적철광의 용해입니다. 철 (III) 설페이트를 형성하기 위해 :
fe₃o₂ (s) + 3h₂so₄ (aq) → fe₂ (so₄) ₃ (aq) + 3h₂o (l)
이 반응은 산성 조건에서 선호된다 및 고온 .
반응 2 :철 (III) 설페이트의 가수 분해
철 (III) 황산염은 매우 가용성 염이지만 물에서 가수 분해 이는 수화 된 철 (III) 산화물 및 황산을 형성하기 위해 물과 반응한다는 것을 의미합니다.
fe₄ (so₂) ₃ (aq) + 6h₂o (l) ⇌ 2fe (OH) ₃ (S) + 3H₂SOA (aq)
이 반응은 가역적이다 pH 및 온도와 같은 요인에 따라 다릅니다. 높은 pH , 평형은 수화 된 철 (III) 산화물의 형성으로 이동한다.
반응 3 :적철광과의 추가 반응
해방 된 황산은 적철광과 추가로 반응하여 철 (II) 설페이트 (Feso₄)의 형성을 초래할 수있다. . :
fe₃o₂ (s) + h₂so₄ (aq) → feso₄ (aq) + fe (OH) ₃ (s) + h₂o (l)
요약 및 실제적 영향 :
황산과 적철광 사이의 전반적인 반응은 다양한 철 화합물의 형성을 초래하는 복잡한 과정이다. 특정 제품과 그 상대 금액은 다음과 같은 요소에 따라 다릅니다.
황산의 * 농도 : 더 높은 농도는 철 (III) 설페이트의 형성을 선호한다.
* 온도 : 더 높은 온도는 반응을 가속화합니다.
* 다른 이온의 존재 : 다른 이온의 존재는 반응 경로에 영향을 줄 수 있습니다.
이 반응은 다양한 산업 공정에서 사용됩니다.
* 철 추출 : 철광석에서 철을 추출하는 데 사용됩니다.
* 철 설페이트 생산 : 철 황산염은 비료, 수처리 및 기타 응용 분야에 사용됩니다.
* 산세 : 강철 표면에서 녹과 다른 산화철을 제거하는 데 사용됩니다.
중요한 참고 : 이 반응은 매우 발발하여 열을 생성한다는 것을 의미합니다. 이러한 반응을 적절한 안전 조치로 처리하는 것이 중요합니다.