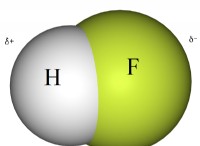
* 해리 : NaCl이 물에 용해되면 이온으로 분리됩니다 :Na+ 및 Cl-. 이것은 순수한 물에 비해 용액에 더 많은 입자를 생성합니다.
* 증기 압력 : 이들 용해 된 이온의 존재는 용액의 증기압을 감소시킨다. 증기 압력은 액체의 액체 증기에 의해 액체 상으로 가해지는 압력이다.
* 끓는점 : 증기 압력이 대기압과 같을 때 액체가 끓습니다. 염 용액의 증기압이 낮기 때문에 대기압에 도달하고 끓기 위해 더 높은 온도가 필요합니다.
간단한 용어로 : 용해 된 이온은 액체를 빠져들고 증기가되는 물 분자를 방해합니다. 이 간섭을 극복하고 물을 끓이기 위해 용액을 더 높은 온도로 가열해야합니다.