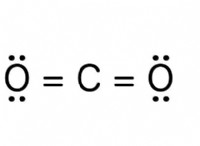* 반응성과 주기성 표 : 주기성 테이블 (그룹 17, 할로겐)에서 그룹을 아래로 이동하면 일반적으로 반응성이 감소합니다. 이는 외부 전자가 핵에서 멀어 지므로 전자를 얻기가 어렵 기 때문입니다.
* 염소 대 브롬 : 염소 (CL)는 그룹 17에서 브롬 (BR)보다 높으며, 이는 염소가 더 반응성이라는 것을 의미합니다.
* 반응 : 염소 가스 (CLine)가 칼륨 브로마이드 (KBR) 용액으로 거품을 낼 때, 염소는 브로마이드 이온 (BRO)으로부터 브롬을 대체하여 브로민 (BRO) 및 클로라이드 이온 (CL)을 형성한다.
화학 방정식 :
cl₂ (g) + 2kbr (aq) → 2kcl (aq) + br₂ (l)
왜 발생하는지 :
* 더 반응성이 높은 염소는 전자를 얻는 경향이 더 강합니다.
* 염소는 브로마이드 이온에서 전자를 가져 와서 브롬으로 산화시킵니다.
* 염소 원자는 전자를 얻어 염화물 이온으로 감소합니다.
반응 관찰 :
* 브롬의 형성으로 인해 솔루션이 적갈색으로 변하는 것을 볼 수 있습니다.
* 반응은 방출되는 브롬 가스로부터 매운 악취를 일으킨다.
키 포인트 :
* 이것은 단일 변위 반응으로,보다 반응성이 높은 원소는 화합물로부터 덜 반응성이있는 요소를 대체합니다.
* 반응은 그룹 17 (할로겐) 내에서 반응성의 경향을 강조합니다.