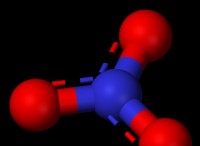
유사한 공식을 가진 더 가능성있는 분자는 CH2Cl2 (디클로로 메탄)입니다. Lewis Dot 구조를 그리는 방법은 다음과 같습니다.
1. 총 원자가 전자 수를 계산하십시오 :
- 탄소 (C) :4
- 수소 (H) :1 x 2 =2
- 염소 (CL) :7 x 2 =14
- 총 :4 + 2 + 14 =20 원자가 전자
2. 중앙에 가장 전기 음성 원자 (탄소)를 놓고 단일 결합으로 주변 원자에 연결합니다. .
3. 고독한 쌍을 첨가하여 주변 원자 (수소와 염소)의 낙지를 완성합니다.
4. 중앙 원자 (탄소)에 옥셋이 있는지 확인하십시오. 그렇지 않은 경우, 고독한 쌍을 주변 원자에서 이동시켜 이중 또는 삼중 결합을 형성하십시오.
Ch2Cl2의 Lewis Dot 구조는 다음과 같습니다.
```
시간
|
cl -c -cl
|
시간
```
설명 :
- 탄소는 중앙에 2 개의 하이드로겐과 2 개의 염소에 4 개의 단일 결합이 있습니다.
- 각 수소에는 두 개의 전자 (1 개의 결합과 1 개의 고독한 쌍)가 있습니다.
- 각 염소에는 8 개의 전자 (1 개의 결합 및 3 개의 고독 쌍)가 옥셋을 완성합니다.
중요한 참고 : 루이스 구조는 분자 구조의 단순화 된 표현 일뿐입니다. 그들은 분자의 3 차원 모양을 정확하게 보여주지 않으며,이 경우 사면체입니다.