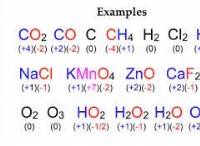
다음은 고장입니다.
* 이온화 에너지 : 기체 상태의 원자 또는 이온에서 전자를 제거하는 데 필요한 에너지.
* 첫 번째 이온화 에너지 : 원자에서 첫 번째 전자를 제거하는 데 필요한 에너지.
* 질소 : 원자 번호 7이있는 요소는 7 개의 전자가 있음을 의미합니다.
* 기체 상태 : 원자는 서로 상호 작용하지 않습니다.
상징적으로, 그것은 :로 표시 될 수 있습니다
n (g) + 에너지 → n⁺ (g) + e⁻
질소의 첫 번째 이온화 에너지는 1402.3 kJ/mol 입니다 . 이 상대적으로 높은 값은 다음과 같은 요인에 기인합니다.
* 작은 원자 반경 : 질소는 작은 원자 반경을 가지며, 이는 가장 바깥 전자가 핵에 의해 더 단단히 고정된다는 것을 의미합니다.
* 높은 핵 전하 : 질소는 높은 핵 전하를 가지고 있으며, 이는 전자를 강력하게 끌어 들이고 있습니다.
* 반으로 가득 찬 p- 궤도 : 질소는 2P- 궤도에 3 개의 전자를 가지므로 반으로 가득 찬 구성을 제공하며, 이는 상대적으로 안정적이며 전자를 제거하기 위해 더 많은 에너지가 필요합니다.
이 높은 이온화 에너지는 질소의 강한 공유 결합을 형성하는 경향과 실온에서 가스로서의 안정성에 기여합니다.