주요 차이 - 원자 궤도 대 분자 궤도
orbital은 전자를 찾을 확률이 높은 영역으로 정의됩니다. 원자는 핵 주위에 자체 전자가 회전합니다. 이들 궤도가 결합을 통해 분자를 형성하기 위해 겹치면, 궤도를 분자 궤도라고한다. 원자가 결합 이론 및 분자 궤도 이론은 각각 원자 및 분자 궤도의 특성을 설명한다. 궤도는 최대 2 개의 전자를 보유 할 수 있습니다. 원자와 분자 궤도의 주요 차이점은 원자 궤도의 전자가 하나의 양성 핵에 의해 영향을 받는다는 것입니다 , 분자 궤도의 전자는 분자의 원자 수에 따라 2 개 이상의 핵에 의해 영향을받는 반면 .
이 기사는
에 대해 설명합니다 1. 원자 궤도
- 정의, 특성, 속성
2. 분자 궤도
- 정의, 특성, 기능
3. 원자 궤도와 분자 궤도의 차이점은 무엇입니까

원자 궤도
원자 궤도는 전자를 찾을 확률이 가장 높은 영역입니다. 양자 역학은 원자 전자의 위치 확률을 설명합니다. 주어진 프롬프트에서 전자의 정확한 에너지를 설명하지 않습니다. Heisenberg의 불확실성 원칙에 설명되어 있습니다. 원자의 전자 밀도는 Schrodinger 방정식의 용액에서 찾을 수 있습니다. . 원자 궤도는 최대 2 개의 전자를 가질 수 있습니다. 원자 궤도는 s, p, d 및 f sublevels로 표시됩니다. 이 궤도마다 모양이 다릅니다. S 궤도는 구형이며 최대 2 개의 전자를 보유합니다. 하나의 하위 에너지 수준이 있습니다. p 궤도는 아령 모양이며 최대 6 개의 전자를 유지할 수 있습니다. 그것은 세 가지 하위 에너지 수준을 가지고 있습니다. D와 F 궤도는 더 복잡한 모양을 가지고 있습니다. D 레벨에는 5 개의 서브 에너지 그룹이 있으며 최대 10 개의 전자를 보유하는 반면 F 레벨은 7 개의 하위 에너지 레벨을 가지며 최대 10 및 15 전자를 보유 할 수 있습니다. 궤도의 에너지는 s
의 순서입니다
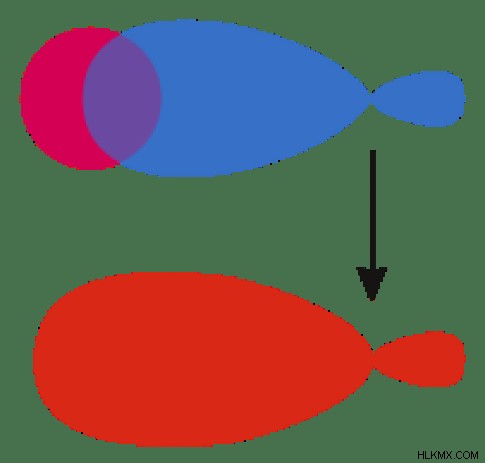
그림 1 :원자 궤도 유형 분자 궤도의 특성은 분자 궤도 이론에 의해 설명됩니다. F. Hund와 R.S.가 처음 제안했습니다. 분자 궤도 이론에 따르면, 원자가 분자를 형성하기 위해 융합 될 때, 겹치는 원자 궤도는 핵의 영향으로 인해 형태를 잃게된다. 분자에 존재하는 새로운 궤도는 이제 분자 궤도라고합니다. 분자 궤도는 거의 동일한 에너지 원자 궤도의 조합에 의해 형성된다. 원자 궤도와는 달리, 분자 궤도는 분자의 단일 원자에 속하지 않지만 분자를 만드는 모든 원자의 핵에 속합니다. 따라서, 상이한 원자의 핵은 다핵 핵으로서 작동한다. 분자 궤도의 최종 모양은 분자를 만드는 원자 궤도의 형태에 의존합니다. aufbau 규칙에 따르면 분자 궤도는 저 에너지 궤도에서 고 에너지 궤도로 채워집니다. 원자 궤도와 마찬가지로 분자 궤도는 최대 2 개의 전자 수를 담을 수 있습니다. 그러나 Pauli의 원칙에 따라 ,이 두 전자는 반대 스핀을 가져야합니다. 분자 궤도에서 전자의 거동은 Schrodinger 방정식 를 사용하여 설명 할 수 있습니다. . 그러나 분자의 복잡성으로 인해 Schrodinger 방정식의 적용은 매우 어렵습니다. 따라서 과학자들은 분자에서 전자의 거동을 대략적으로 평가하는 방법을 개발했습니다. 이 방법은 원자 궤도의 선형 조합이라고합니다 (LCAO) 방법.
그림 2 :분자 궤도 형성
원자 궤도 : 원자 궤도는 원자에서 전자를 찾을 확률이 가장 높은 영역입니다. 분자 궤도 : 분자 궤도는 분자의 전자를 찾을 확률이 가장 높은 영역입니다.
원자 궤도 : 원자 궤도는 원자 주위의 전자 구름에 의해 형성됩니다. 분자 궤도 : 분자 궤도는 거의 동일한 에너지를 갖는 원자 궤도의 융합에 의해 형성됩니다.
원자 궤도 : 원자 궤도의 모양은 원자 궤도 (S, P, D 또는 F)의 유형에 의해 결정됩니다. 분자 궤도 : 분자 궤도의 모양은 분자를 만드는 원자 궤도의 형태로 결정됩니다.
원자 궤도 : Schrodinger 방정식 사용됩니다.
분자 궤도 : 원자 궤도의 선형 조합 (lcao)가 사용됩니다.
원자 궤도 : 원자 궤도는 단일 핵 주위에서 발견되는 단일 중심적입니다.
분자 궤도 : 분자 궤도는 다른 핵 주위에서 발견되는다고합니다.
원자 궤도 : 단일 핵은 원자 궤도에서 전자 구름에 영향을 미칩니다
분자 궤도 : 분자 궤도의 전자 구름에 두 개의 더 많은 핵이 더 많은 것입니다. 원자와 분자 궤도는 각각 원자와 분자에서 가장 높은 전자 밀도를 갖는 영역입니다. 원자 궤도의 특성은 원자의 단일 핵에 의해 결정되는 반면, 분자 궤도의 특성은 분자를 형성하는 원자 궤도의 조합에 의해 결정된다. 이것은 원자 궤도와 분자 궤도의 주요 차이점입니다.
참고 문헌 :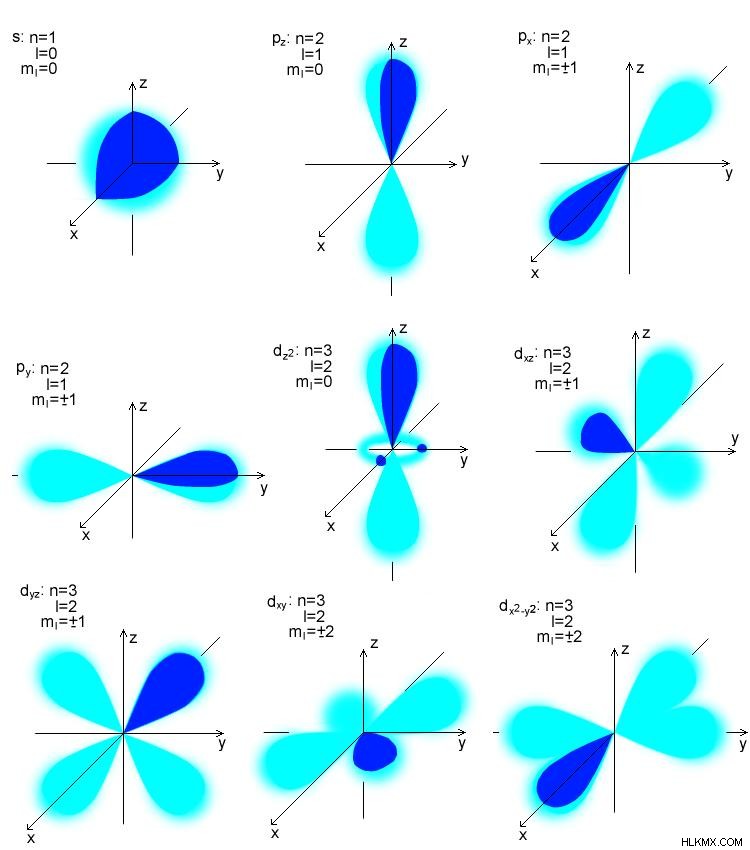
분자 궤도
원자 궤도와 분자 궤도의 차이
정의
형성
모양
전자 밀도를 설명
핵
핵의 효과
요약
1. Verma, N.K., Khanna, S. K., &Kapila, B. (2010). 포괄적 인 화학 XI. Laxmi Publications.
2.ucko, D. A. (2013). 화학의 기초. Elsevier.
3.mackin, M. (2012). 화학을위한 기본 사항을 동반하기위한 ST udy 가이드 . elsevier.