* 염화나트륨 (NaCl) : 일반적인 테이블 소금.
* 이산화탄소 (Co₂) : 종종 용액에서 버블 링되는 무색 가스.
* 물 (h>o) :
이 반응의 균형 화학적 방정식은 다음과 같습니다.
Nahco₃ (aq) + HCl (aq) → NaCl (aq) + co₂ (g) + h₂o (l)
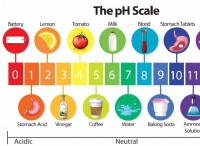
주요 관찰 :
* 피즈 : 가장 눈에 띄는 효과는 이산화탄소 가스의 방출로 인한 피즈 또는 버블 링입니다.
* 열 생산 : 반응은 약간 발열이므로 소량의 열을 방출합니다.
* 솔루션 변경 : 염산이 반응함에 따라 용액은 덜 산성이 될 것이다.
응용 프로그램 :
이 반응은 다음을 포함한 여러 응용 프로그램이 있습니다.
* 베이킹 : 중탄산 나트륨은 베이킹의 일반적인 누룩 제로, 산성 성분과 반응하여 이산화탄소 거품을 생산하여 구운 제품이 상승합니다.
* 항산제 : 중탄산 나트륨은 또한 과도한 위산을 중화시키기위한 제산제로 사용됩니다.
* 화학 시연 : 이 반응은 종종 화학 시연에 사용되어 가스 생산 및 산-염기 반응을 설명합니다.