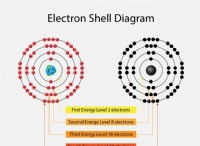
소금물의 전기 분해 (NaCl 용액) :
1. 전극 : 소금물의 전기 분해는 양극 (양의 전극)과 음극 (음성 전극)을 사용합니다.
2. 반응 :
* 양극 (산화) : 2Cl (aq) → Cl₂ (g) + 2E⁻ (염소 가스가 생산됨)
* 음극 (환원) : 2H +O (L) + 2E⁻ → H₂ (g) + 2oh⁻ (aq) (수소 가스가 생성되고 수산화 이온이 형성됨)
3. 순 반응 : 2NaCl (aq) + 2H₂O (L) → Cl₂ (g) + h₂ (g) + 2Naoh (aq)
주요 테이크 아웃은 캐소드에서 수산화 이온 (OH⁻)의 형성입니다. 수산화물 이온은 용액을보다 기본적으로 만들어 pH를 증가시킨다.
pH :에 영향을 미치는 요인
* 전해질 농도 : 더 높은 농도의 소금은 더 높은 농도의 수산화 이온 및 더 많은 알칼리성 pH를 초래할 것이다.
* 전류 밀도 : 전류 밀도가 높을수록 전기 분해가 빠르고 수산화물 이온 생산이 더 높아서 pH가 더 높아질 것입니다.
* 전기 분해 기간 : 전기 분해 공정이 길수록 수산화 이온이 생성되어 pH가 더욱 증가합니다.
요약하면, 전기 분해 후 소금물 용액의 pH는 7보다 높을 것이며, 이는 기본 솔루션을 나타냅니다.