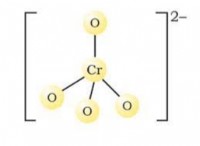
1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D
분해합시다 :
* 1s² : 첫 번째 에너지 수준 (n =1)은 S 서브 쉘에 2 개의 전자를 갖습니다.
* 2s² 2p⁶ : 두 번째 에너지 수준 (n =2)은 S 서브 쉘에 2 개의 전자와 P 서브 쉘에 6 개의 전자를 갖는다.
* 3S² 3p⁶ : 세 번째 에너지 수준 (n =3)은 S 서브 쉘에 2 개의 전자와 P 서브 쉘에 6 개의 전자를 갖는다.
* 4S² : 네 번째 에너지 수준 (n =4)은 S 서브 쉘에 2 개의 전자를 갖습니다.
* 3d 3 : 세 번째 에너지 수준 (n =3)은 또한 D 서브 쉘에 6 개의 전자를 갖는다.
중요한 참고 : 4S 서브 쉘은 3D 서브 쉘 이전에 채워집니다. 3D 서브 쉘이 에너지 수준이 낮더라도 4S 서브 쉘은 에너지가 약간 낮기 때문입니다.
이 전자 구성은 금속 광택 및 +2 또는 +3 전하로 이온을 형성하는 능력과 같이 철이 왜 특성을 갖는지를 설명합니다.