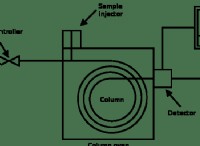
1. 산화 및 환원을 식별하십시오
* 산화 : 아연 (Zn)은 산화되어 전자를 잃어 버렸다.
* 감소 : Cucl의 구리 (I) 이온 (Cu⁺)이 감소되어 구리 금속 (Cu)을 형성하기 위해 전자를 얻습니다.
2. 반 반응 를 작성하십시오
* 산화 반 반응 :
Zn (s) → zn²⁺ (aq) + 2e⁻
* 감소 반 반응 :
cu + (aq) + e⁻ → cu (s)
3. 반 반응의 균형을 유지하십시오
* 산화 : 반 반응은 이미 원자와 전하 측면에서 균형을 이룹니다.
* 감소 : 충전의 균형을 맞추려면 전체 반응에 2를 곱해야합니다.
2cu⁺ (aq) + 2E⁻ → 2CU (S)
4. 반 반응을 결합하십시오
* 전체 산화 환원 반응 :
Zn (S) + 2CU⁺ (AQ) → Zn²⁺ (AQ) + 2CU (S)
중요한 참고 : 이 균형 잡힌 반응은 전체 과정을 나타내지 만 Cucl은 그 자체로 안정적인 화합물이 아니라는 점에 주목할 가치가 있습니다. 전형적인 반응에서, Cucl은 아마도 이온 및 클로 이온으로서 용액에있을 수있다.