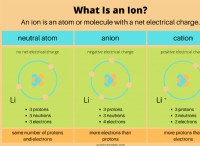
nh₄⁺ + hno₃ → no₃⁻ + h₂o
이 방정식의 균형을 잡는 방법은 다음과 같습니다.
1. 요소를 식별하십시오 :
* 질소 (N)
* 수소 (H)
* 산소 (O)
2. 양쪽에 원자를 계산하십시오 :
* 반응물 (왼쪽) :
* N :2
* H :5
* O :3
* 제품 (오른쪽) :
* n :1
* H :2
* O :3
3. 요소의 균형 :
* 질소 : 제품 측면에 NOIT 앞에 계수를 넣으십시오.
* 수소 : 제품 측면에 HATER 앞에 2의 계수를 넣으십시오.
4. 최종 균형 방정식 :
nh₄⁺ + hno₃ → 2no₃⁻ + 2h₂o
설명 :
* 이제 각 요소의 원자 수는 방정식의 양쪽에서 동일합니다.
* 질소 : 양쪽에 2
* 수소 : 양쪽에 5
* 산소 : 양쪽에 6
중요한 메모 :
* 제공 한 방정식에는 일부 요금이 누락 된 것 같습니다. 올바른 형태는 암모늄 이온 (NH₄⁺) 및 질산 이온 (NOI)과 함께입니다.
*이 반응은 특정 조건 하에서 질산 암모늄 (NH₄NO)의 이산화 질소 (NOI), 물 (HATER) 및 아산화 질소 (NALO)의 분해를 나타냅니다.
* 균형 화학 방정식은 질량 보존 법칙이지지되도록 보장합니다. 즉, 각 요소의 원자 수는 반응 내내 일정하게 유지됩니다.