2 차 반응은 2 개의 1 차 반응물 또는 1 차 반역자의 농도에 의존하는 화학 반응입니다.
2 차 반응이 위에서 설명한 두 가지 유형 중 하나 일 수 있기 때문에 다음과 같이 속도를 일반화 할 수 있기 때문입니다.
r =k [a] x [b] y
반응 속도 :
반응을하자-aa + bb cc + dd
반응물 농도 측면에서 2 차 반응 속도는 r =k [a] x [b] y
로 표시 될 수 있습니다.[a] 및 [b] 반응물 농도는이 경우 상수입니다.
x와 y는 화학적 계수 a와 b.
가 아닌 실험적으로 결정된 반응 순서입니다.화학 반응 순서는 변수 x와 y의 합에 의해 결정됩니다. 2 차 반응은 x + y =2의 반응입니다. 이것은 하나의 반응물이 농도 제곱에 비례하여 속도로 소비되는 경우 (rate =k [a] 2), 또는 두 반응물이 농도 제곱에 비례하여 소비되는 경우 (rate =k [a] [b]). 2 차 프로세스 '속도 상수 K는 M-1S-1에서 측정됩니다.
몇 가지 예 :
N2ois는 일산화 질소와 산소로 분류됩니다. 다음은 응답입니다.
2n2o 2no + o2
수소 이온과 하이드 록실 이온이 물을 구성합니다.
h + + oh – h2o
베이스의 존재에서 에스테르의 가수 분해가 발생합니다.
CH3COOC2H5 + naOH ch3coona + c2h5oh
수소 요오드 라이드는 두 가지 가스로 나뉩니다 :수소와 요오드.
.2hi → h2+ i2
2 차 반응을위한 차동 및 통합 속도 방정식
2 차 반응물의 경우 화학 반응에서 특정 제품을 생성하는 2 차 반응물의 사례에서, 차등 법칙 방정식은 다음과 같습니다.
.-d [a]/dt =k [a] 2
적분 속도 방정식을 도출하려면이 차동 형태는 다음과 같이 재 배열되어야합니다.
-d [a]/[a] 2 =-kdt
이러한 반응의 반 수명 :
화학 반응의 반감기는 초기 반응물의 절반이 반응을 통과하는 데 걸리는 시간입니다. 결과적으로 반응의 반 생명을 결정하려고 시도하면서 다음과 같은 대체를해야합니다.
r =[r] o2
및
t =t12
이 값이 2 차 반응에 대한 속도 방정식의 적분 형태로 대체되면, 우리는 다음을 얻습니다.
1 [r] 02–1 [r] 0 =kt1/2
결과적으로, 2 차 반응의 반감기 방정식은 다음과 같이 표현 될 수 있습니다.
t1/2 =1k [r] 0
첫 번째와 2 차 반응의 차이 :
| PROTHTOUTS |
|
| 반응 속도가 두 번째 반응에 의해 결정됩니다. 관련된 반응물. |
|
| . | ||
|
|
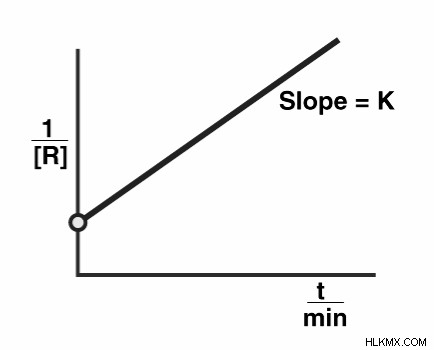
| 2 차 반응의 그래프 :
결론 :2 차 반응은 1 차 반응물 또는 2 개의 1 차 반응제의 농도에 의해 결과가 결정되는 화학 반응의 한 유형입니다. 2 차 반응에서, 요금 법률의 지수의 총은 2와 같습니다.
r =k [a] x [b] y는 2 차 반응의 속도입니다. |