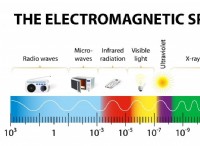
1. Soolar :의 몰 질량을 결정하십시오
* 황 (s)은 32.06 g/mol의 어금니 질량 을가집니다.
* 산소 (O)는 어금니 질량 16.00 g/mol입니다.
* So mass는 32.06 + (2 * 16.00) =64.06 g/mol입니다.
2. SO₂ :의 두더지 수를 계산하십시오
* 몰스 =질량 / 어금니 질량
* 몰스 =576 g / 64.06 g / mol
* Moles =9 mol
3. STP :에 이상적인 가스 법칙을 적용하십시오
* STP (표준 온도 및 압력)에서 1 몰의 가스는 22.4 L을 차지합니다.
* 부피 =두더지 * STP의 어금니 부피
* 부피 =9 mol * 22.4 l/mol
* 볼륨 = 201.6 l
따라서 STP의 576 그램의 SO₂ 가스는 201.6 리터의 양을 차지합니다.