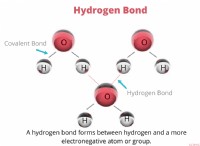
1. 충돌 이론 :
* 온도 증가 =충돌 증가 : 온도가 증가함에 따라, 반응물 (티오 설페이트 나트륨 및 염산)의 분자는 운동 에너지를 얻고 더 빨리 움직입니다. 이것은 분자들 사이의 더 빈번한 충돌로 이어진다.
* 증가 된 에너지 =더 효과적인 충돌 : 운동 에너지가 높으면 분자가 더 많은 힘과 충돌한다는 것을 의미합니다. 활성화 에너지로 알려진 특정 최소 에너지의 에너지는 성공적인 충돌을 위해 반응을 일으킨다. 더 높은 온도에서는 더 많은 충돌은 활성화 장벽을 극복하기에 충분한 에너지가있어 더 성공적인 반응을 초래합니다.
2. 속도 상수 (k) :
* 화학 반응에서 속도 상수 (k)는 반응이 얼마나 빨리 진행되는지를 측정하는 것입니다. 온도는 속도 상수에 직접적인 영향을 미칩니다.
* Arrhenius 방정식 : 온도와 속도 상수 사이의 관계는 Arrhenius 방정식에 의해 설명됩니다. k =a * exp (-ea/rt), 여기서 :
* A는 사전 지수 요인 (충돌 빈도와 관련)입니다.
* EA는 활성화 에너지입니다.
* R은 이상적인 가스 상수입니다.
* t는 절대 온도입니다.
* 더 높은 온도 =더 높은 k : Arrhenius 방정식은 온도가 증가함에 따라 지수 항이 더 작아지면 (음수 부호로 인해) k에 더 큰 값이 나타납니다. 이는 반응 속도가 온도에 따라 기하 급수적으로 증가 함을 의미합니다.
반응 :
티오 설페이트 나트륨과 염산 간의 반응은 황량한 침전물 인 황과 다른 생성물을 생성합니다. 반응 속도는 용액이 반응 용기 아래에있는 마크를 가릴 정도로 흐려지는 데 걸리는 시간에 의해 측정 될 수 있습니다.
실험적으로 :
더 높은 온도에서 반응이 훨씬 빠르게 진행된다는 것을 알 수 있습니다. 이것은 다음과 같습니다.
* 더 성공적인 충돌 : 더 높은 온도에서 충돌 주파수와 에너지가 증가하면 더 성공적인 충돌이 유황 형성으로 이어집니다.
* 높은 속도 상수 : 높은 온도에서 증가 된 속도 상수는 반응을보다 빠르게 전진시킵니다.
요약 :
온도는 티오 설페이트 나트륨과 염산 간의 반응 속도를 다음과 같이 증가시킨다 :
* 반응물 분자들 사이의 충돌의 빈도와 효과를 증가시킨다.
* 반응 속도를 직접 반영하는 속도 상수의 값을 증가시킵니다.